
| A. | 氢气与氯气应分别贮存在钢瓶中,并放在同一安全室集中保存 | |
| B. | 电石、Na2O2着火时,不能用常规的水枪灭火 | |
| C. | 可燃性颗粒(如面粉,漆粉)弥漫到空气中,可能会引起爆炸 | |
| D. | 油锅着火可用金属锅盖盖灭 |
分析 A.氢气与氯气光照条件下发生爆炸;
B.电石与水反应生成乙炔,过氧化钠与水反应生成氧气;
C.易燃颗粒能够燃烧引起爆炸;
D.隔绝空气可以灭火.
解答 解:A.氢气与氯气应分别贮存在钢瓶中,不能在同一安全室集中保存,故A错误;
B.电石与水反应生成乙炔,乙炔为可燃气体,过氧化钠与水反应生成氧气,氧气为助燃气体,所以电石、Na2O2着火时,不能用常规的水枪灭火,故B正确;
C.可燃性颗粒(如面粉,漆粉)弥漫到空气中,可能会引起爆炸,应注意禁烟火,故C正确;
D.油锅着火可用金属锅盖盖灭,隔绝空气,能够灭火,故D正确;
故选:A.
点评 本题考查了化学与安全,明确物质的性质是解题关键,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:解答题
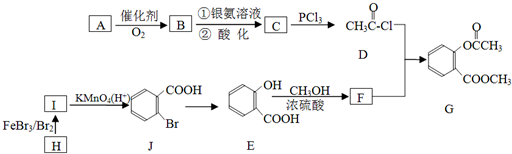
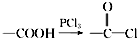 ,请回答以下问题:
,请回答以下问题: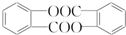 .
.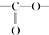 结构
结构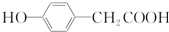 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的氨水和NaOH溶液各1.0 L含有的OH-数目均为0.1NA | |
| B. | 常温常压下,由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | 22 gD218O分子中,含有质子数和中子数分别为10NA和12NA | |
| D. | 标准状况下,22.4 L CCl4中含有的C-Cl键数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
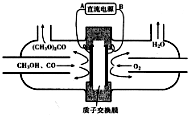
| A. | 外电源负极为A极 | |
| B. | 阳极的电极反应:2CH3OH+CO-2e-═(CH3O)2CO+2H+ | |
| C. | H+从右向左通过质子交换膜 | |
| D. | 电解槽中添加少量烧碱有利于导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂白粉溶液中通入SO2:Ca2++ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O | |
| D. | 向Na2S2O3溶液中加入稀硫酸:S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④③⑤⑥② | B. | ①⑤③④⑥② | C. | ①③④⑥⑤② | D. | ①③⑤⑥④② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、蛋白质都能发生水解反应,都属于天然有机高分子 | |
| B. | 乙醇和2-丙醇(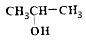 )属于同系物,其催化氧化的产物也属于同系物c )属于同系物,其催化氧化的产物也属于同系物c | |
| C. | 等质量的乙酸和葡萄糖完全燃烧,消耗氧气的量相等 | |
| D. | 淀粉、纤锥素、蔗糖都属于天然高分子化合物,而且水解产物中都有葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com