
分析 (1)NaNO2为强碱弱酸盐,亚硝酸根离子能发生水解;
(2)NaNO2有氧化性,能将碘离子氧化成碘单质,据此答题;
(3)①根据氧化还原滴定的操作可确定所用仪器;
②因为高锰酸钾的稀溶液是红色的,所以滴定终点时,溶液会出现红色;
③根据电子得失守恒可知关系式2KMnO4~5NaNO2,由关系式根据消耗的高锰酸钾溶液的物质的量可计算出亚硝酸钠的质量,进而确定隔夜熟肉中NaNO2的含量,并据此判断能否食用.
解答 解:(1)NaNO2为强碱弱酸盐,亚硝酸根离子能发生水解,水解的离子方程式为NO2-+H2O?HNO2+OH-,
故答案为:NO2-+H2O?HNO2+OH-;
(2)NaNO2有氧化性,能将碘离子氧化成碘单质,所以要酸性条件下,NaNO2能使淀粉、KI溶液变蓝,
故答案为:NaNO2;
(3)①根据氧化还原滴定的操作可知,用到的仪器为酸式滴定管、锥形瓶;
故答案为:BE;
②因为高锰酸钾的稀溶液是红色的,所以滴定终点时,溶液会出现红色,所以滴定终点的判断依据为:(滴入最后一滴标准液时)锥形瓶内溶液变红,且30秒内不褪色,
故答案为:(滴入最后一滴标准液时)锥形瓶内溶液变红,且30秒内不褪色;
③根据题意可知,与隔夜熟肉中提取的NaNO2反应的KMnO4的物质的量为0.00500mol/L×0.016L=8.0×10-5 mol,根据电子得失守恒可知关系式2KMnO4~5NaNO2,由关系式可知亚硝酸钠的质量为$\frac{5}{2}$×8.0×10-5 mol×69g/mol=13.8mg,所以隔夜熟肉中NaNO2的含量为$\frac{13.8mg}{1kg}$=13.8mg/Kg<30mg/kg,所以能食用,
故答案为:13.8;能.
点评 本题主要考查盐的水解原理的应用、实验基本操作和实验原理的应用分析,中等难度,答题时注意把元素化合物知识与实验原理充分结合,注意化学用语的正确书写,侧重于考查学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 复分解反应 | B. | 置换反应 | C. | 化合反应 | D. | 分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O+H2O?H3O++OH- | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | Fe3++Fe?2Fe2+ | D. | HNO3?H++NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2=2H++2e- | B. | H2+2OH--2e-═2H2O | ||
| C. | O2+2H2O+4e-═4OH- | D. | 4H++O2═2H2O-4e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 个 | B. | 3 个 | C. | 4 个 | D. | 5 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0-2min的平均速率v(X)=0.01mol/(L•min) | |
| B. | 平衡时Y的转化率为0.5 | |
| C. | 其它条件不变,升温,平衡逆向移动 | |
| D. | 其它条件不变,增加X的浓度,v正增大,v逆减少,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.43mol | B. | 2mol | C. | 0.8mol | D. | 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
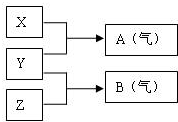 X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:请针对以下两种不同的情况回答:
X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:请针对以下两种不同的情况回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com