
【题目】在密闭容器中的一定量混合气体发生反应:x A(g) + y B(g) ![]() z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
A.x + y < z B.B的转化率降低
C.平衡向正反应方向移动 D.C的体积分数增大
【答案】B
【解析】
试题分析:A、其它条件不变时,将容器的容积扩大到原来的两倍,由![]() 可知A的浓度立即减半,变为0.5 mol/L ÷ 2 = 0.25 mol/L,再次达到平衡时,测得A的浓度降低为0.3 mol/L,说明减小压强能使x A(g) + y B(g)
可知A的浓度立即减半,变为0.5 mol/L ÷ 2 = 0.25 mol/L,再次达到平衡时,测得A的浓度降低为0.3 mol/L,说明减小压强能使x A(g) + y B(g) ![]() z C(g)的平衡向逆反应方向移动,由于减小压强能使平衡向气体物质的量或体积增大方向移动,则逆反应是气体物质的量或体积增大的方向,则x + y > z,A错误;B、由于增大容积的实质是减小压强,减小压强能使平衡向气体物质的量或体积增大的方向移动,即逆向移动,因此反应物B的转化率减小,B正确;C、由上述分析可知,平衡向逆反应方向移动,C错误;D、由于平衡向气体物质的量增大或逆反应方向移动,因此C的物质的量减小,而混合气体总的物质的量增大,因此C的物质的量分数减小,D错误;答案选B。
z C(g)的平衡向逆反应方向移动,由于减小压强能使平衡向气体物质的量或体积增大方向移动,则逆反应是气体物质的量或体积增大的方向,则x + y > z,A错误;B、由于增大容积的实质是减小压强,减小压强能使平衡向气体物质的量或体积增大的方向移动,即逆向移动,因此反应物B的转化率减小,B正确;C、由上述分析可知,平衡向逆反应方向移动,C错误;D、由于平衡向气体物质的量增大或逆反应方向移动,因此C的物质的量减小,而混合气体总的物质的量增大,因此C的物质的量分数减小,D错误;答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】净化汽车尾气对于保护环境意义重大。其中的一个反应原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)+Q(Q>0)。
N2(g)+2CO2(g)+Q(Q>0)。
回答下列问题:
(1)一定温度下,将等物质的量的NO和CO通入固定容积为4L的密闭容器中,反应过程中部分物质的物质的量变化如图所示,则0~20min平均反应速率v(NO)为_____________。

(2)如图所示,若Y表示平衡常数,只改变某一反应条件X,反应由平衡I达到新平衡Ⅱ,则条件X为_______________,NO的转化率为平衡I_________平衡Ⅱ(填:“大于”、“小于”或“不变”)

(3).能判断该反应达到平衡状态的标志是_______________(选填编号)
a.v生成(CO2)=v消耗(CO) b.混合气体的平均相对分子质量不再改变
c.平衡常数保持不变 d.NO、CO、N2、CO2的浓度均不再变化

(4).在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在上图中,补充画出从t2到t4时刻正反应速率随时间的变化曲线________ 。
(5).三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2,其反应分两步进行。第一步是:C3N3(OH)3![]() 3HCNO;第二步是HCNO与NO2反应,把氮元素和碳元素转变成无毒气体。请写出第二步发生的化学反应方程式______________________________________,每消除1mol NO2转移电子_________个。
3HCNO;第二步是HCNO与NO2反应,把氮元素和碳元素转变成无毒气体。请写出第二步发生的化学反应方程式______________________________________,每消除1mol NO2转移电子_________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示关系,则下列有关叙述正确的是( )

A. H2A的电离方程式为H2A ![]() H++HA-,HA-
H++HA-,HA- ![]() H++A2
H++A2
B. pH=4的H2A水溶液中c(OH-)=10-12 mol·L-1
C. NaHA、NaHB的混合溶液中,阴离子有A2-、HA-、HB-、B2-、OH-
D. Na2B的水溶液能与H2A溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某品牌食用碘盐包装上的部分文字,下列叙述不正确的是

A. 包装上的(以I计)中的“I”指的是碘元素
B. 碘酸钾溶于水的电离方程式为:KIO3===K++I—+O2—
C. 人体缺碘可引起甲状腺肿大
D. 待食品熟后加入可有效防止碘酸钾分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(![]() )的工艺流程如下:
)的工艺流程如下:
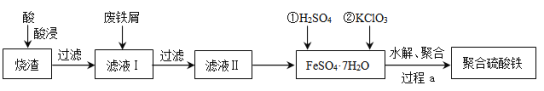
(1)酸浸时最合适的酸是_____(写化学式)。
(2)酸浸后溶液中主要的阳离子有_____。
(3)加入KClO3的目的是_____________________________(结合离子方程式说明)。
(4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。
_____Fe2(SO4)3+_____H2O![]() ______Fe2(OH)x(SO4)3-
______Fe2(OH)x(SO4)3-![]() + _____ ______
+ _____ ______
(5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因__________。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:![]() (n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0 mL。
①该聚合硫酸铁样品中n(OH-) =_________mol。
②已知该样品中Fe的质量分数w,则盐基度B=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列事实不能说明NH3H2O为弱电解质的是
A. 0.1 molL-1 NH3H2O溶液的pH小于13
B. Al(OH)3在浓氨水中不能溶解
C. 相同条件下,浓度均为0.1 molL-1的NaOH溶液和氨水,氨水的导电能力弱
D. 向0.1 molL-1 NH3H2O溶液中加入MgCl2溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能证明甲酸(HCOOH,一元酸)为弱酸的是( )
A.0.1mol/L甲酸的pH为2.3
B.将pH=2的甲酸稀释100倍后,溶液的pH小于4
C.温度升高,溶液的导电能力增强
D.等体积等浓度的甲酸和HCl与足量的锌反应,产生等量的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9 日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如![]() 、
、![]() 等。下列说法正确的是( )
等。下列说法正确的是( )
A.![]() 和
和![]() 的化学性质不同
的化学性质不同
B.Ts位于周期表的第六周期ⅦA族
C.元素Ts的相对原子质量为293.5
D.![]() 和
和![]() 质子数相同,中子数不同
质子数相同,中子数不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com