
【题目】提纯下列物质(括号内为杂质),所选除杂试剂及方法均正确的是( )
选项 | 物质 | 除杂试剂 | 方法 |
A | 酒精(水) | CaO | 蒸馏 |
B | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
C | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
D | 苯(溴) | KI溶液 | 分液 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是俄罗斯化学家门捷列夫提出“元素周期律”150周年。门捷列夫为好几种当时尚未发现的元素![]() 如“类铝”、“类硅”和“类硼”
如“类铝”、“类硅”和“类硼”![]() 留下了空位。而法国科学家在1875年研究闪锌矿(ZnS)时发现的“镓”,正是门捷列夫预言的“类铝”,性质也是和预言中惊人的相似。
留下了空位。而法国科学家在1875年研究闪锌矿(ZnS)时发现的“镓”,正是门捷列夫预言的“类铝”,性质也是和预言中惊人的相似。
回答下列问题:

(1)①写出镓的基态原子的电子排布式______;门捷列夫预言的“类硼”就是现在的钪、“类硅”即使现在的锗,这三种元素的原子中,未成对的电子数最多的是______![]() 填元素符号
填元素符号![]() 。
。
②下列说法最有可能正确的一项是______。![]() 填字母
填字母![]()
A.类铝在![]() 时蒸气压很高
时蒸气压很高 ![]() 类铝的氧化物不能溶于碱
类铝的氧化物不能溶于碱
C.类铝不能与沸水反应 ![]() 类铝能生成类似明矾的矾类
类铝能生成类似明矾的矾类
![]() 氯化镓熔点77.9℃,其中镓的杂化方式与下列微粒的中心原子杂化方式相同且氯化镓空间构型也与其微粒相同的是______。
氯化镓熔点77.9℃,其中镓的杂化方式与下列微粒的中心原子杂化方式相同且氯化镓空间构型也与其微粒相同的是______。![]() 填字母
填字母![]()
A.PCl3B.SO3C.CH3-D.NO3-
(3)镓多伴生在铝土矿、二硫镓铜矿等矿中。
①Cu(OH)2可溶于氨水,形成的配合物中,配离子的结构可用示意图表示为![]() 用“
用“![]() ”表示出配位键
”表示出配位键![]() ______。
______。
②锌的第一电离能(I1)大于铜的第一电离能,而锌的第二电离能(I2)却小于铜的第二电离能的主要原因是______。
(4)2011年,我国将镓列为战略储备金属,我国的镓储量约占世界储量的80%以上。砷化镓也是半导体材料,其结构与硫化锌类似,其晶胞结构如图所示:
①原子坐标参数是晶胞的基本要素之一,表示晶胞内部各原子的相对位置。图中A(0,0,0)、![]() 、
、![]() ,则此晶胞中,距离A球最远的黑球的坐标参数为______。
,则此晶胞中,距离A球最远的黑球的坐标参数为______。
![]() 若砷和镓的原子半径分别为acm和bcm,砷化镓的摩尔质量Mg/mol为、密度为ρg/cm3,晶胞中原子体积占空间体积百分率为w即原子体积的空间占有率
若砷和镓的原子半径分别为acm和bcm,砷化镓的摩尔质量Mg/mol为、密度为ρg/cm3,晶胞中原子体积占空间体积百分率为w即原子体积的空间占有率![]() ,则阿伏加德罗常数为______mol-1。
,则阿伏加德罗常数为______mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,各反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g),K=1×10-30;
2NO(g),K=1×10-30;
②2H2(g)+O2(g)![]() 2H2O(g),K=2×1081;
2H2O(g),K=2×1081;
③2CO2(g)![]() 2CO(g)+O2(g),K=4×10-92
2CO(g)+O2(g),K=4×10-92
则常温下,NO、H2O、CO2这三个化合物分解放氧的倾向最大的是( )
A.① B.② C.③ D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容条件下发生下列反应:2X2O5 (g) ![]() 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s | 0 | 50 | 100 | 150 |
c(X2O5) mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
下列说法错误的是
A. T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B. 50s 内 X2O5分解速率为 0.03 mol/ (Ls)
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D. 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在文物的保护和鉴定方面发挥着重要的作用。已知氨水能够清洗壁画表面的污垢,醋酸可以固色。某文物保护单位现用500 mL容量瓶配制0.1 mol·L-1的氨水,以下操作正确的是
A. 将标准状况下1.12 L NH3溶于500 mL水中
B. 将标准状况下1.12 L NH3溶于水配成500 mL溶液
C. 取1 mol·L-1的氨水50 mL,加入500 mL水中
D. 取1 mol·L-1的氨水100 mL,配成1 000 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:

流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1) 为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:
①适当升高温度;②搅拌;③________等。
(2) 加入H2O2时发生主要反应的离子方程式为________________。
(3) “除铁”时,控制溶液pH的范围为______________。
(4) 滤渣B的主要成分的化学式为______________。
(5) 已知:Ksp(NiCO3)=1.42×10-7。为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>________mol·L-1。
(6) “氧化”生成Ni2O3的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂钻合金是以铂为基含钻二元合金,在高温下,铂与钻可无限互溶,其固溶体为面心立方晶格。铂钻合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表电子钟表磁控管等。
(1)基态钴原子的价电子排布图为______。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如图)。科学研究表明,顺式分子具有抗癌活性。

①吡啶分子是大体积平面配体,其结构简式如图所示,每个分子中含有的σ键数目为______。二氯二吡啶合铂分子中所含的C、N、Cl三种元素的第一电离能由大到小的顺序是______。
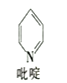
②二氯二吡啶合铂中存在的微粒间作用力有______(填字母)。
a.范德华力b.氢键c.金属键d非极性键
③反式二氯二吡啶合铂分子是______(填“极性分子”或“非极性分子”)。
(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如图所示。

①“分子金属”可以导电,是因为______能沿着其中的金属原子链流动。
②“分子金属”中,铂原子是否以sp3的方式杂化?______(填“是”或“否”),其理由是______。
(4)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构(如图所示,小球表示Co原子,大球表示O原子),图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是______(填字母)。

(5)金属铂品体中,铂原子的配位数为12,其立方晶胞沿式x、y或z轴的投影图如图所示,若金属铂的密度为dgm-3,则晶胞参数a=______nm(列计算式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com