
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |

分析 (1)根据SO2和先水反应生成H2SO3,然后H2SO3不稳定能被空气中的氧气氧化生成H2SO4;
(2)根据酸性氧化物和碱反应生成盐和水,注意弱电解质写化学式;
(3)①根据溶液中HSO3-浓度和SO32-浓度的相对大小确定溶液的酸碱性;
②根据溶液中电荷守恒和物料守恒确定溶液中各种离子浓度的关系;
(4)①阳极上阴离子放电发生氧化反应;
②阴极上氢离子得电子发生还原反应,同时生成亚硫酸根离子,溶液中钠离子向阴极移动,导致生成吸收液.
解答 解:(1)SO2和先水反应生成H2SO3,反应方程式为:SO2+H2O?H2SO3;H2SO3不稳定能被空气中的氧气氧化生成H2SO4,反应方程式为2H2SO3+O2=2H2SO4;
故答案为:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4;
(2)SO2和氢氧化钠反应生成亚硫酸钠和水,反应方程式为:2OH-+SO2=SO32-+H2O;
故答案为:2OH-+SO2=SO32-+H2O;
(3)①在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性;亚硫酸氢根离子既能水解又能电离,亚硫酸氢钠溶液呈酸性同时说明HSO3-的电离程度大于水解程度.
故答案为:酸;HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度;
②当溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度.
a、溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,所以c(Na+)=2c(SO32-)+c(HSO3-),故a正确.
b、溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故b正确.
c、溶液呈电中性,溶液中阴阳离子所带电荷相等,得c(Na+)+c(H-)=2c(SO32-)+c(HSO3-)+c(OH-),故c错误.
故答案为:ab;
(4)①当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+.
故答案为:HSO3-+H2O-2e-=SO42-+3H+;
②电解时,溶液中阳离子向阴极移动,氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,导致加速HSO3-电离生成SO32-,钠离子进入阴极室,吸收液就可以再生.
故答案为:氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
点评 本题考查了污染物的处理,涉及到离子方程式、化学方程式和离子浓度大小的比较等知识点,难度中等,需要注意的是比较溶液中各种离子浓度相对大小时要结合电荷守恒和物料守恒分析解答.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
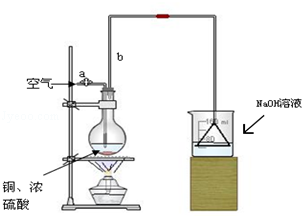
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
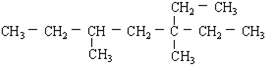 的名称3,5-二甲基-3-乙基庚烷
的名称3,5-二甲基-3-乙基庚烷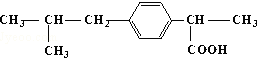 所含官能团的名称羧基
所含官能团的名称羧基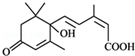 所含官能团的名称碳碳双键、羟基、羰基、羧基.
所含官能团的名称碳碳双键、羟基、羰基、羧基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏和煤的干馏都属于物理变化 | |
| B. | 通过对95%的酒精直接蒸馏获得无水酒精 | |
| C. | 在石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计水银球的位置分别位于蒸馏烧瓶支管口、反应液液面以下、水浴中 | |
| D. | 用C8H18萃取溴水中的溴,可观察到溶液分层,下层为橙红色,上层接近无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
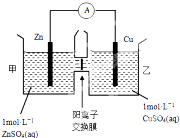 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸溶液 | B. | 弱酸性溶液 | C. | 弱碱性溶液 | D. | 强碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
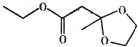
| A. | 苹果酯分子中含有14个氢原子 | |
| B. | 苹果酯能在NaOH溶液中发生水解反应 | |
| C. | 苹果酯能与金属钠反应产生氢气 | |
| D. | 苹果酯与C2H5OOCCH2CH2COOC2H5互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com