
 氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:分析 (1)根据氧化亚铜的颜色确定添加Cu2O的涂斜或玻璃的颜色即可;
(2)①在电解池的阴极上是溶液中的阳离子发生得电子的还原反应,根据放电顺序来回答;
②在碱性环境下,CuCln1-n和氢氧根离子之间发生反应得到转红色沉淀,据此书写离子方程式;
(3)①反应中化合价升高的元素是Fe,化合价降低的元素是Mn,根据电子守恒来配平方程式即可;
②高锰酸钾具有强氧化性,据此选择滴定管;
③根据发生的反应找到Cu2O和KMnO4之间的关系式,进行相应的计算即可.
解答 解:(1)氧化亚铜的颜色是砖红色,所以添加Cu2O的涂斜或玻璃显砖红色,
故答案为:砖红;
(2)①在电解池的阴极上是溶液中的阳离子发生得电子的还原反应,根据放电顺序,发生的反应为:2H2O+2e-=H2↑+2OH-,
故答案为:2H2O+2e-=H2↑+2OH-;
②在碱性环境下,CuCln1-n和氢氧根离子之间发生反应得到转红色沉淀,离子方程式CuCln1-n+2OH-=Cu2O↓+H2O+2nCl-,
故答案为:CuCln1-n+2OH-=Cu2O↓+H2O+2nCl-;
(3)①反应FeSO4+KMnO4+H2SO4→Fe2(SO4)3+MnSO4+K2SO4+H20中化合价升高的元素是Fe,共升高2价,化合价降低的元素是Mn,降低5价,根据电子守恒,含锰元素的物质前边系数是2,铁原子数是10,硫酸亚铁前边是10,硫酸铁前边是5,根据元素守恒,配平其他物质,结果为:10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H20,
故答案为:10;2;8;5;2;1;8;
②高锰酸钾具有强氧化性,应该选择酸式滴定管,
故答案为:酸式;
③根据发生的反应Cu2O+Fe2(SO4)3+H2SO4═2FeSO4+2CuSO4+H2O、10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H20,找到Cu2O和KMnO4之间的关系为:Cu2O~$\frac{2}{5}$KMnO4,产品质量为1.0g,滴定时消耗0.10mol•L-1的KMnO4标准溶液20.00mL,則产品中Cu2O的物质的量是$\frac{0.1×0.02}{0.4}$mol=0.005mol,质量分数是$\frac{0.005mol×144g/mol}{1.0g}$×100%=72%.
故答案为:72%.
点评 本题综合考查学生电解原理的应用、电极反应式的书写、氧化还原反应的配平以及物质含量的测定等知识,属于综合知识的考查,题目难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E、F的原子序数依次增大,已知A的原子半径比B的小,B在反应中既不容易得到电子也不容易失去电子,C元素的气态氢化物和其最高价氧化物对应水化物能化合生成盐,元素D的原子最外层电子数是其电子层数的3倍,E与A同一主族,F常用于制半导体.
短周期主族元素A、B、C、D、E、F的原子序数依次增大,已知A的原子半径比B的小,B在反应中既不容易得到电子也不容易失去电子,C元素的气态氢化物和其最高价氧化物对应水化物能化合生成盐,元素D的原子最外层电子数是其电子层数的3倍,E与A同一主族,F常用于制半导体.
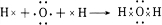 ,写出A2D与X反应的化学方程式,并用单线桥标出电子转移
,写出A2D与X反应的化学方程式,并用单线桥标出电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mo1•L-1 | |
| B. | 标准状况下,22.4L水所含的分子数为NA | |
| C. | 常温常压下NO2和N2O4混合气体22.4L,其中含有的原子总数为0.3NA | |
| D. | 常温下,4gCH4含有NA个C-H共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键是原子轨道以“头碰头”的方式相互重叠 | |
| B. | 共价化合物分子的键能越大,键长越长,则分子越稳定 | |
| C. | 2个原子形成多个共价键中,只有一个σ键,而π键可以是一个或多个 | |
| D. | 形成共价键时键与键重叠程度越大,体系能量越底,键越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .该物质属于共价化合物(填“离子”或“共价”).向X的水溶液中滴加石蕊溶液,会观察到:溶液变红色.并用方程式解释原因NH3+H2O=NH3.H2O?NH4++OH-.
.该物质属于共价化合物(填“离子”或“共价”).向X的水溶液中滴加石蕊溶液,会观察到:溶液变红色.并用方程式解释原因NH3+H2O=NH3.H2O?NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com