
 实验小组的同学探究铁与浓、稀硝酸反应的还原产物.他们通过查资料得知:Nessler试剂(K2HgI4的KOH溶液)可与NH4+反应生成沉淀
实验小组的同学探究铁与浓、稀硝酸反应的还原产物.他们通过查资料得知:Nessler试剂(K2HgI4的KOH溶液)可与NH4+反应生成沉淀分析 (1)铁与足量的浓硝酸在加热条件下反应生成硝酸铁、二氧化氮;
(2)将过量铁加入稀硝酸中一段时间后,取反应完全的溶液少量加入几滴NaOH溶液加热,产生使红色石蕊试纸变蓝的气体,该气体为氨气;
(3)①酸性条件下,硝酸根具有强氧化性,将亚铁离子氧化为铁离子,同时被还原生成NO;
②NO与氧气反应生成红棕色二氧化氮,可以检验生成的气体是否为NO;
③二氧化氮与四氧化二氮之间存在平衡;
(4)由实验可知,铁与稀硝酸反应,还原产物为NH4+和NO.
解答 解:(1)铁与足量的浓硝酸在加热条件下,产生红棕色气体,同时溶液变为黄色,红棕色气体为NO2,黄色溶液中含有的金属阳离子为Fe3+,
故答案为:NO2;Fe3+;
(2)将过量铁加入稀硝酸中一段时间后,取反应完全的溶液少量加入几滴NaOH溶液加热,产生使红色石蕊试纸变蓝的气体,该气体为NH3,
故答案为:NH3;
(3)①酸性条件下,硝酸根具有强氧化性,将亚铁离子氧化为铁离子,同时被还原生成NO,反应离子方程式为:3Fe2++4 H++NO3-=3Fe3++NO↑+2 H2O,
故答案为:3Fe2++4 H++NO3-=3Fe3++NO↑+2 H2O;
②NO与氧气反应生成红棕色二氧化氮,可以检验生成的气体是否为NO,
故答案为:检验产生的NO;
③二氧化氮与四氧化二氮之间存在平衡:2NO2?N2O4,气体的体积减小,
故答案为:2NO2?N2O4;
(4)由实验可知,铁与稀硝酸反应,还原产物为NH4+和NO,
故答案为:铁与稀硝酸反应,还原产物为NH4+和NO.
点评 本题考查物质性质探究实验,注意根据现象分析解答,较好的考查学生分析归纳总结能力,注意元素化合物性质的掌握.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1HCl溶液 | B. | 1mol•L-1MgCl2溶液 | ||
| C. | 2mol•L-1NaCl溶液 | D. | 1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 0.5mol/L MgCl2溶液中,含有Cl-离子数为NA | |
| C. | 2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 标准状况下,22.4L H2O含有氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
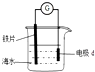
| A. | d为锌块,铁片腐蚀加快 | |
| B. | d为石墨,铁片不易被腐蚀 | |
| C. | d为锌块,铁片上电极反应为:2H++2e-=H2↑ | |
| D. | d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有醇和卤代烃都能发生消去反应 | |
| B. | 甲苯能使溴水因化学反应褪色而苯不能 | |
| C. | 苯酚在70℃水中溶解度不大 | |
| D. | 低级酯的密度一般小于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 氢气可以在氯气中燃烧,说明燃烧反应未必需要氧气参与 | |
| C. | 足量Cl2、S分别和二份等质量的Na反应,两者得到电子一样多 | |
| D. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸根本就不会反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeC13+Cu=CuC12+2FeC12 | B. | AlCl3+3NH3•H20=Al(0H)3↓+3NH4Cl | ||
| C. | 2Fe(0H)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe203+3H20 | D. | Na2O+CO2=Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com