
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | MgO | MgCl2 | Mg(OH)2 |
| C | Si | SiO2 | H2SiO3 |
| D | NaOH | Na2CO3 | Na2SO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铁与氯气反应生成氯化铁,氯化铁与铁反应生成氯化亚铁,氯化亚铁与锌反应生成铁;
B.氧化镁与盐酸反应生成氯化镁,氯化镁与氢氧化钠反应生成氢氧化镁,氢氧化镁分解生成氧化镁;
C.硅与氧气反应生成二氧化硅,二氧化硅不与水反应,不能生成硅酸;
D.氢氧化钠与二氧化碳反应生成碳酸钠,碳酸钠与亚硫酸反应生成亚硫酸钠,亚硫酸钠与氢氧化钡反应生成氢氧化钠.
解答 解:A.铁与氯气反应生成氯化铁,氯化铁与铁反应生成氯化亚铁,氯化亚铁与锌反应生成铁,符合上述转化关系,故A不选;
B.氧化镁与盐酸反应生成氯化镁,氯化镁与氢氧化钠反应生成氢氧化镁,氢氧化镁分解生成氧化镁,符合上述转化关系,故B不选;
C.硅与氧气反应生成二氧化硅,二氧化硅不与水反应,不能生成硅酸,不符合上述转化关系,故C选;
D.氢氧化钠与二氧化碳反应生成碳酸钠,碳酸钠与亚硫酸反应生成亚硫酸钠,亚硫酸钠与氢氧化钡反应生成氢氧化钠,符合上述转化关系,故D不选;
故选:C.
点评 本题考查了物质之间的相互转化,熟悉物质的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验 编号 | T(℃) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表 面积(m2•g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 82 |
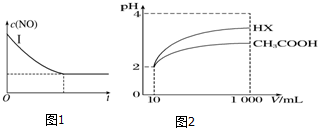
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平 衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 铁的状态 | 盐酸的浓度 | 反应的温度 |
| A | 片状 | 1 mol/L | 20℃ |
| B | 片状 | 3 mol/L | 40℃ |
| C | 粉末 | 1 mol/L | 20℃ |
| D | 粉末 | 3 mol/L | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂不参加化学反应 | B. | 醇和酸反应的产物未必是酯 | ||
| C. | 卤代烃的水解产物一定是醇 | D. | 醇脱水的反应都属于消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1 mol Cu2S,同时生成22.4L SO2 | |
| D. | 有0.2 mol硫被氧化时,转移1.2NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com