
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为________。
(2)Na的原子结构示意图为________,Na在氧气中完全燃烧所得产物的电子式为________。
(3)MgCl在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为__________________________;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为________________(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg 3He,同时可得6000 kg H2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产碳酸氢铵________kg。
[答案] (1)1 (2)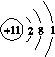
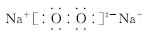
(3)①高 ②SiO2+2OH-===SiO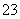 +H2O 原子晶体 ③NaCl,NaClO,Na2CO3
+H2O 原子晶体 ③NaCl,NaClO,Na2CO3
(4)3950
[解析] (3)①离子晶体的熔点与晶格能有关系,形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,晶格能越大,熔点越高;镁离子的半径小于钡离子,故氧化镁的晶格能大于氧化钡的晶格能,则氧化镁的熔点高;②氧化镁是碱性氧化物,二氧化硅是酸性氧化物,可用强碱溶液除去二氧化硅;二氧化硅是由硅原子和氧原子通过共价键形成的空间网状结构的晶体,是原子晶体;③氧化镁、炭粉和氯气制备氯化镁,另一生成物可被氢氧化钠完全吸收,则生成气体是二氧化碳,它与足量氢氧化钠反应生成碳酸钠,过量的氯气与氢氧化钠反应生成氯化钠和次氯酸钠。(4)根据化学方程式3H2+N2 2NH3,结合已知可知N2不足,则最多生成的NH3的物质的量为
2NH3,结合已知可知N2不足,则最多生成的NH3的物质的量为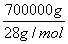 ×2,根据氮原子守恒可知最终生成碳酸氢铵的质量为
×2,根据氮原子守恒可知最终生成碳酸氢铵的质量为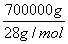 ×2×79 g·mol-1=3 950 000 g=3950 kg。
×2×79 g·mol-1=3 950 000 g=3950 kg。


科目:高中化学 来源: 题型:
下列关于杂化轨道的叙述中,不正确的是()
A. 分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构
B. 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子
C. N2分子中N原子没有杂化,分子中有1个σ键、2个π键
D. H2SO4分子中三种原子均以杂化轨道成键
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列反应的化学方程式,并注明相关反应的反应类型。
(1)葡萄糖与乙酸作用生成葡萄糖五乙酸酯
方程式__________________________________________________________。
反应类型________________________________________________________。
(2)葡萄糖与H2作用生成己六醇
方程式___________________________________________________________。
反应类型________________________________________________________。
(3)葡萄糖与新制Cu(OH)2悬浊液作用生成红色沉淀
方程式__________________________________________________________。
反应类型_________________________________________________________。
(4)蔗糖酸性条件下水解
方程式__________________________________________________________。
反应类型________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.Cl2通入NaOH溶液:
Cl2+OH-===Cl-+ClO-+H2O
B.NaHCO3溶液中加入稀盐酸:
CO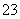 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:
Al3++4NH3·H2O===AlO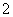 +4NH
+4NH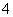 +2H2O
+2H2O
D.Cu溶于稀HNO3:
3Cu+8H++2NO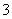 ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与日常生活密切相关,下列说法错误的是( )
A.碘酒是指单质碘的乙醇溶液
B.84消毒液的有效成分是NaClO
C.浓硫酸可刻蚀石英制艺术品
D.装饰材料释放的甲醛会造成污染
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mLzxxk
查看答案和解析>>
科目:高中化学 来源: 题型:
已知33As、35Br位于同一周期,下列关系正确的是
A.原子半径:As>C1>P B.热稳定性:HC1>AsH3>HBr
C.还原性:As3−>S2−>C1− D.酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com