
| A、除去MgCl2酸性溶液中的Fe3+:加热搅拌,加入MgCO3,过滤,加适量的盐酸 |
| B、制备硅酸胶体:向硅酸钠水溶液中逐滴滴加稀盐酸至溶液呈强酸性 |
| C、检验Fe2(SO4)3溶液中是否含有FeSO4:滴加少许酸性高锰酸钾溶液,并振荡 |
| D、使盛有少量氢氧化镁沉淀的试管中的沉淀溶解:加入一定量的氯化铵溶液 |


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | ||||
B、向铜作电极电解硫酸溶液:2H2O
| ||||
| C、向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | ||||
| D、向AlCl3溶液中加入过量的Na:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
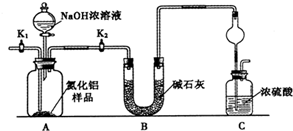
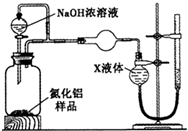
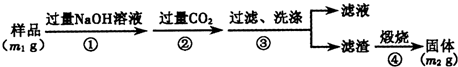
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素A在周期表中的位置为第2周期ⅥA族 |
| B、元素A、B、C的原子半径由大到小的顺序为r(C)>r(B)>r(A) |
| C、A、B两种元素的氢化物的稳定性A>B |
| D、1mol C2B2与足量的AB2完全反应转移约6.02×1023个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入少量氯化钾固体 |
| B、加入少量氯化铁固体 |
| C、减少Fe(SCN)3的浓度 |
| D、加水稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) |
| B、c(H2C2O4)>c(C2O42-) |
| C、c(H+)+c(Na+)=c(OH-)+c(C2O42-)+c(HC2O4-) |
| D、c(Na+)>c(HC2O4-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、空气、SO2、NO、NO2 |
| B、KNO3溶液、Fe2+、H+、I- |
| C、NaHCO3溶液、Ca2+、OH-、Cl- |
| D、由水电离产生的c(H+)=10-11mol?L-1的溶液K+、SO42-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、简单离子半径:W>Z>Y |
| B、X与Y形成的化合物中,既含极性键又含非极性键的物质至少有2种 |
| C、Z与W形成的化合物一定是离子化合物 |
| D、Y的最高价氧化物对应的水化物的酸性一定比W的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com