
����Ŀ��������H��һ�����ϣ������ڽ����У���������·�ߺϳ���

�ش��������⣺
��1��11.2 L����״��������A�������г��ȼ�տ��Բ���88g CO2��45gH2O��A�ķ���ʽ��___________��
��2��D�����ƣ�ϵͳ������Ϊ____________________��
��3���ڴ���������1mol F��2 mol H2��Ӧ������3-����-1-������F�Ľṹ��ʽ��_______________��
��4����Ӧ���ķ�Ӧ������___________________��
��5����Ӧ���Ļ�ѧ����ʽΪ___________________��
��6����G������ͬ�Ĺ����ŵķ�����ͬ���칹����________�֣�����G��������HNMR��������壬�������Ϊ1��1��2��2��2���칹��Ľṹ��ʽ��___________________ ��
���𰸡�C4H10 2-����ϩ ![]() ��ȥ��Ӧ (CH3)2CHCH2OH+
��ȥ��Ӧ (CH3)2CHCH2OH+![]()
![]()
![]() +H2O 4
+H2O 4 ![]()
��������
���⡰ͻ�ƿڡ����ڶ�A��B��C�ĽṹA��������״����11.2LA�����ʵ���Ϊ0.5mol��ȼ������2mol CO2��2.5molH2O������ȼ�շ�Ӧ��̼����ԭ���غ��1molA�����к�4molC��10molH��A�ķ���ʽΪC4H10��Aͬ���칹����������(CH3CH2CH2CH3)���춡��[(CH3CH(CH3)2]���ٴ�һ�ȴ����������һ�ȴ�����ȥ��Ӧ����Ƕȷ�����Aֻ�����춡����NaOH����Һ��±������ȥ��Ӧ����������ȥ����D����![]() �����ݡ���֪��2������E��(CH3)2CHCH2OH������1molF��2molH2�ӳɺ���3-����-1-��������̼���Լ�F���롰����Cu(OH)2����Һ��Ӧ��ȷ��F��
�����ݡ���֪��2������E��(CH3)2CHCH2OH������1molF��2molH2�ӳɺ���3-����-1-��������̼���Լ�F���롰����Cu(OH)2����Һ��Ӧ��ȷ��F��![]() ������ȷ��G��
������ȷ��G��![]() ��Ũ����������E+G��H��Ӧ����������Ӧ���ɴ˷������
��Ũ����������E+G��H��Ӧ����������Ӧ���ɴ˷������
(1)11.2L����![]() =0.5mol������A�к�̼ԭ��
=0.5mol������A�к�̼ԭ��![]() ������ԭ��
������ԭ��![]() ����1molA�к�̼ԭ��2mol��0.5=4mol������ԭ��5mol��0.5=10mol������A�ķ���ʽΪC4H10��
����1molA�к�̼ԭ��2mol��0.5=4mol������ԭ��5mol��0.5=10mol������A�ķ���ʽΪC4H10��
(2)��ΪB��C����A��һ�ȴ�������NaOH����Һ�й��ȷ�����ȥ��Ӧ����ͬ������D��˵��B��C��̼����ͬ��A�ķ���ʽΪC4H10��A������ͬ���칹�壺�����飨CH3CH2CH2CH3�����춡��[CH3CH(CH3)2]�������춡���һ�ȴ�����2��CH2ClCH(CH3)2��CH3CCl(CH3)2������ȥ��Ӧ���ɵ��л����ﶼ��![]() ������D�Ľṹ��ʽΪ
������D�Ľṹ��ʽΪ![]() ��ϵͳ����Ϊ��2-����ϩ��
��ϵͳ����Ϊ��2-����ϩ��
(3)��F��������Cu(OH)2����Һ��Ӧ����F�����к���ȩ����-CHO��,1molF��2molH2�ӳɺ�IJ���Ϊ3-����-1-����������-OH��ȩ������õ�������1molH2ֻ����1mol>C=C<�ӳɵõ�������F�Ľṹ��ʽ![]() ��
��
(4) ��Ӧ����һ�ȴ��춡����NaOH����Һ���ȷ�����ȥ��Ӧ�����Է�Ӧ��������ȥ��Ӧ��
(5)�������������֪D��(CH3)2C=CH2��D��E���ϡ���֪(2)������EΪ(CH3)2CHCH2OH����(3)֪F�Ľṹ��ʽΪ![]() ��F��G�Ĺ�����2��������ȩ��������Ϊ�Ȼ������Σ�Ȼ���Ȼ������α��ữ�����Ȼ�������G�Ľṹ��ʽΪ
��F��G�Ĺ�����2��������ȩ��������Ϊ�Ȼ������Σ�Ȼ���Ȼ������α��ữ�����Ȼ�������G�Ľṹ��ʽΪ![]() ��(CH3)2CHCH2OH��
��(CH3)2CHCH2OH��![]() ��Ũ���������·���������Ӧ�����Է�Ӧ�ڵĻ�ѧ����ʽΪ��(CH3)2CHCH2OH+
��Ũ���������·���������Ӧ�����Է�Ӧ�ڵĻ�ѧ����ʽΪ��(CH3)2CHCH2OH+![]()
![]()
![]() +H2O��
+H2O��
(6)G�Ľṹ��ʽΪ![]() ������дͬ���칹������G������ͬ�Ĺ����ŵķ����ࡱ���ʣ�����дͬ���칹���к�һ��������һ��>C=C<��һ��-COOH���Ƚ�������>C=C<��ϣ����ԡ���Ч��ԭ�ӡ���˼����-COOH��-COOHȡ��λ����ͼ��
������дͬ���칹������G������ͬ�Ĺ����ŵķ����ࡱ���ʣ�����дͬ���칹���к�һ��������һ��>C=C<��һ��-COOH���Ƚ�������>C=C<��ϣ����ԡ���Ч��ԭ�ӡ���˼����-COOH��-COOHȡ��λ����ͼ��![]() �����Тپ���G���������G����4�֡�����HNMR��������壬�������Ϊ1��1��2��2��2���칹��Ľṹ��ʽΪ
�����Тپ���G���������G����4�֡�����HNMR��������壬�������Ϊ1��1��2��2��2���칹��Ľṹ��ʽΪ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժ�����Ƚ������о�Ժ�ɹ��з���һ�ָ�Ч�ͳɱ����ܵ����������һʯī��˫���ӵ�أ�����ܷ�ӦΪAl+xC+Li++PF6 ��![]() AlLi+Cx PF6�����йظõ�ص�˵����ȷ����
AlLi+Cx PF6�����йظõ�ص�˵����ȷ����
A. �ŵ�ʱ��PF6���������ƶ�
B. �ŵ�ʱ��������ӦΪA1��3e��====Al3+
C. ���ʱ�������缫���ӵ��������
D. ���ʱ��������ӦΪxC+PF6����e��==CxPF6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��ں����ܱ������з������·�Ӧ��2A(g)+B(g)![]() 3C(g)������Ӧ��ʼʱ����2 mol A��2 mol B����ƽ���A���������Ϊa%��������������ʱ�������������������Ϊ��ʼ���ʣ�ƽ���A�������������a%����
3C(g)������Ӧ��ʼʱ����2 mol A��2 mol B����ƽ���A���������Ϊa%��������������ʱ�������������������Ϊ��ʼ���ʣ�ƽ���A�������������a%����
A. 2.5mol C B. 2 mol A��2 mol B��10 mol He�����μӷ�Ӧ��
C. 1.5 mol B��1.5 mol C D. 2 mol A��3 mol B��3 mol C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�٢ڢܱۢ�ʾ�ɲ�ͬ��ѧԪ����ɵĻ��������˵����ȷ����
A. ����Ϊij�������ӵ���ɵ�λ�����������Ǻ�����
B. ������ϸ���еĴ������ʣ����һ����֬��
C. �����Dz������Ŵ����ʣ����һ����RNA
D. ������ֲ��ϸ���ڵ���Ҫ�ɷ֣���ܿ�������ά��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���pH=12��NaOH��Һ100 mL��������pH��Ϊ11(��Һ��Ϻ�������仯��������������С�����һλ)��
��1������pH=10��NaOH��Һ��Ӧ����_________mL��
��2������pH=2�����ᣬӦ����_________mL��
��3������ˮϡ�ͣ������ˮ�����Ϊ____________________ mL��
��4��������,��pH=5��H2SO4��Һ����ˮ�������H+Ũ��Ϊc1��pH=11��NaOH��Һ����ˮ�������H+Ũ��Ϊc2,��c1/c2=_________��
��5�������£�pH=11��NaOH��ҺaL��pH=5��H2SO4��ҺbL��ϣ������û����Һ�����ԣ���a��b=_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH=2��A��B��������Һ��1 mL���ֱ��ˮϡ�͵�1 000 mL����pH����Һ���V�Ĺ�ϵ��ͼ��ʾ��

����˵����ȷ������ ��
A. A��B������Һ�����ʵ���Ũ��һ�����
B. ϡ�ͺ�A����Һ�����Ա�B����Һǿ
C. a=5ʱ��A��ǿ�ᣬB������
D. ��A��B�������ᣬ��5��a��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������仯��������������;�㷺��
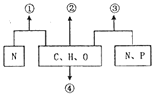
������������ɰ�ķ���һһȷþ��(��Ҫ�ɷ�ΪMgCO3.SiO2,����������Fe2O3��MnO��CaO��)Ϊ��Ҫԭ����ȡ����̼��þ[MgCO3:Mg(OH)2:2H2O]�Ĺ�ҵ��������:
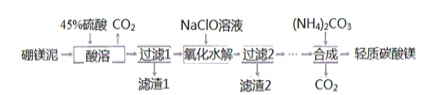
��1��д��������"һ���У�MgCO3�����ᷴӦ�����ӷ���ʽ________________________��
��2������2����Ҫ�ɷ���MnO2��____��д������MnO2�����ӷ���ʽ_____________��
��3�����ϳɡ�ʱ��ͨ������80�棬���ȱ߽��裬�¶Ȳ��ܳ�80���ԭ����________��
II.�Ӻ�ͭ�ḻ����Ȼ��Դ��ͭ��(CuFeS2)ұ��ͭ�Ĺ�����������:
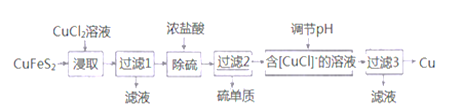
��֪:��CuFeS2+3CuCl2=4CuCl��+FeCl2+2S�� ��+1�۵�Cu���������������绯
��4����ȡʱ��������FeCl3��Һ��Ҳ������CuCl��S���÷�Ӧ��ѧ����ʽΪ_______________��
��5��������1������Һ��ֻ��FeCl2�������ڿ����м������ɡ����պ����ù���Ļ�ѧʽΪ__________��
��6��������Һ��pH������Cu�⣬���ܲ���һ�ֽ������ӣ��˽���������______���������ӷ��ţ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ������������ȷ����(����)
A.��ѧ��������ԭ��֮�䣬Ҳ�����ڷ���֮��
B.����ԭ��֮�������ý�����ѧ��
C.���Ӽ�������������֮����������
D.��ѧ��ͨ����ָ���ڵ���������ԭ��֮��ǿ�ҵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2O�㷺�������Ϻͻ��������Ĵ�����
���Ʊ�Cu2O
��1����ⷨ����ҵ����ͭ����������ƬΪ���������һ��Ũ�ȵ�NaOH ��Һ���Ʊ�������ͭ��д�������ĵ缫��ӦʽΪ_____________________
��2����Һ-��ԭ������ 100�� Cu��NO3��2 ��ˮ��Һ�м���һ������� NaOH ˮ��Һ��������ʹ֮��Ͼ��ȣ� ����μ���ˮ���µ�ˮ��Һ��ֱ��������ɫ�����������ˡ�ϴ�Ӻ���ո���õ�Cu2O ��ĩ��
��֪�� N2H4��l��+O2��g��=N2��g��+2H2O��l����H= -akJ/mol
Cu(OH)2��s��=CuO��s��+H2O��l����H= +bkJ/mol
4CuO��s��=2Cu2O��s��+O2��g����H= +ckJ/mol
����N2H4 ��Cu(OH)2 ��Ӧ�Ʊ� Cu2O ���Ȼ�ѧ����ʽΪ ________________________��
��ҵ����Cu2O �� ZnO ��ɵĴ��������ڹ�ҵ�Ϻϳɼ״��� CO(g)+2H2(g)![]() CH3OH(g) ��H = -90.8 kJ/mol���ش��������⣺
CH3OH(g) ��H = -90.8 kJ/mol���ش��������⣺
��1����˵����ӦCO(g)+2H2(g)![]() CH3OH(g)�Ѵ�ƽ��״̬������_______��
CH3OH(g)�Ѵ�ƽ��״̬������_______��
A������Ӧ����ЧӦ��H = -90.8 kJ/mol ʱ��Ӧ�ﵽƽ��״̬
B.�ں��º�ѹ�������У����������ܶȱ��ֲ���
C.�ھ��Ⱥ��ݵ������У���Ӧ��ƽ�ⳣ�����ٱ仯
D���ں��º��ݵ������У������ƽ��Ħ���������ٱ仯
��2���� T1��ʱ�����Ϊ 2 L �ĺ��������г������ʵ���֮��Ϊ 3mol �� H2 ��CO������ʼ n(H2)��n(CO)= 2 ʱ������ 5min �ﵽƽ�⣬CO ��ת����Ϊ 0.6����0~5min ��ƽ����Ӧ���� v (H2)=___�����¶��µ�ƽ�ⳣ��Ϊ__________________ ������ʱ���������м���CO(g) �� CH3OH(g)�� 0.4mol������ƽ��ʱ H2 ��ת���ʽ� ______������� ����С�����䡱����
��3����ҵʵ�ʺϳ� CH3OH �����У�������ͼM�������N���Ӧ�ķ�Ӧ���������û�ѧ��Ӧ���ʺͻ�ѧƽ��֪ʶ��ͬʱ��������ʵ�ʣ�˵��ѡ��÷�Ӧ���������ɣ�________��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com