
、TiO2可通过下述两种方法制备金属钛:
方法一:电解TiO2来获得Ti,将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用石墨作电解槽池.
(1)阳极的电极反应式为 .
(2)电解过程中需定期更换石墨电极的原因是 .
方法二:先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti.
(3)TiO2(s)+2Cl2(g)⇌TiCl4(l)+O2(g)△H=+151kJ•mol﹣1该反应难以发生,原因是 .
不能直接由TiO2 和Cl2反应(即氯化反应)来制取TiCl4,当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使反应在高温条件下能顺利进行.
(4)已知:C(s)+O2(g)=CO2(g)△H=﹣394kJ•mol﹣1
TiO2(s)+C(s)+2Cl2(g)=TiCl4(l)+CO2(g)△H=
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因 .
考点:
电解原理;热化学方程式.
专题:
化学反应中的能量变化.
分析:
(1)电解池的阴极上得电子反应还原反应生成金属钛,阳极上是氧离子失电子发生氧化反应产生氧气;
(2)根据电解槽的阳极是氧离子失电子发生氧化反应产生氧气进行分析;
(3)用判据△H﹣T△S来判断反应能否发生;
(4)将方程式TiO2(s)+2Cl2(g)⇌TiCl4(l)+O2(g)△H=+151kJ•mol﹣1和C(s)+O2(g)=CO2(g);△H=﹣394kJ•mol﹣1相加,得出TiO2与Cl2、C反应制各TiCl4的热化学方程式;
(5)向TiO2(s)+2Cl2(g)⇌TiCl4(l)+O2(g)反应体系中加C,能反应掉生成物O2,从化学平衡移动的角度分析.
解答:
解:(1)电解时,阴极上得电子发生还原反应,电极反应式为TiO2+4e﹣=Ti+2O2﹣,阳极上是氧离子失电子发生氧化反应产生氧气,电极反应为:2O2﹣﹣4e﹣=O2,故答案为:2O2﹣﹣4e﹣=O2;
(2)由于电解过程中,电解槽的阳极产生氧气,碳单质会与阳极产生的氧气反应而不断减少,所以电解过程中需定期向电解槽池中加入炭块,
故答案为:碳单质会与阳极产生的氧气反应而不断减少;
(3)TiO2(s)+2Cl2(g)⇌TiCl4(1)+O2(g)△H=+151kJ/mol该反应中,反应物有2mol气体,生成物只有1mol气体,△S<0,又△H>0,则△H﹣T△S>0,故反应不能自发进行,故答案为:该反应的△H>0,△S<0,反应难以自发进行;
(4)已知:①TiO2(s)+2Cl2(g)⇌TiCl4(l)+O2(g)△H=+151kJ•mol﹣1
②C(s)+O2(g)=CO2(g);△H=﹣394kJ•mol﹣1
据盖斯定律,①+②得:TiO2(s)+2Cl2(g)+C(s)=TiCl4(l)+CO2(g)△H=+151kJ•mol﹣1﹣394kJ•mol﹣1=﹣243KJ•mol﹣1,故答案为:﹣243KJ•mol﹣1;
(5)在反应TiO2(s)+2Cl2(g)⇌TiCl4(l)+O2(g)中,加入C能和O2反应C(s)+O2(g)=CO2(g),降低了O2的浓度,平衡正向移动,反应就可以进行了,
故答案为:TiO2(s)+2Cl2(g)⇌TiCl4(1)+O2(g) 碳与氧气反应,减小了产物O2(g)的浓度,平衡向正反应方向移动,使反应能顺利进行.
点评:
本题考查范围广,落点比较高,是易错题,设计电化学、热化学等知识的考查,注意热化学反应方程式相加减时,反应热应相应的加减.


科目:高中化学 来源: 题型:
下图的各方框表示有关的一种反应物或生成物(某些
物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
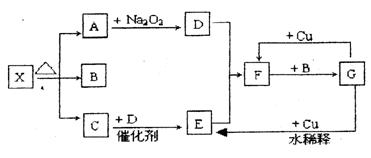
 (1)写出下列各物质的化学式:
(1)写出下列各物质的化学式:
X: ;B: ;F:  ;G: 。
;G: 。
(2)写出下列变化的反应方程式:
A→D: ; G→E: 。
(3)实验室里,常用加热 的混合物的方法 制取气体C,常采用 法来收集,可否用无水CaCl2干燥气体C (填“否”或者“可以”)。
制取气体C,常采用 法来收集,可否用无水CaCl2干燥气体C (填“否”或者“可以”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用碳酸钙与1mol/L稀盐酸反应制取二氧化碳,下列措施对化学反应速率几乎没有影响的是( )
|
| A. | 改用浓度为0.5mol/L的稀硫酸 |
|
| B. | 加入更多的碳酸钙 |
|
| C. | 稍微加热,升高反应温度 |
|
| D. | 加入少量醋酸钠晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
3I﹣+S2O82﹣=I3﹣+2SO42﹣的反应速率可以用I3﹣与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I﹣)/mol•L﹣1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82﹣)/mol•L﹣1 | 0.040 | 0.040 | 0.080 | c1 | 0.080 |
| t/s | 88.0 | 44.0 | 22.0 | 22.0 | t2 |
下列说法不正确的是( )
|
| A. | 该实验的目的是探究I﹣与S2O82﹣浓度对反应速率的影响 |
|
| B. | 若在40℃下进行编号③对应浓度的实验,显色时间的范围为<22.0s |
|
| C. | 实验④c1=0.020 mol•L﹣1 |
|
| D. | 实验⑤显色时间t2=11 s |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语或名称,表达正确的是( )
A. 聚丙烯的结构简式为: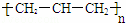 B. 苯分子的比例模型:
B. 苯分子的比例模型:
C. 四氯化碳分子的电子式为: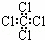 D. 乙烯的结构简式:CH2CH2
D. 乙烯的结构简式:CH2CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验探究:探究碳、硅元素的非金属性的相对强弱.根据要求完成下列各小题.
(1)实验装置:
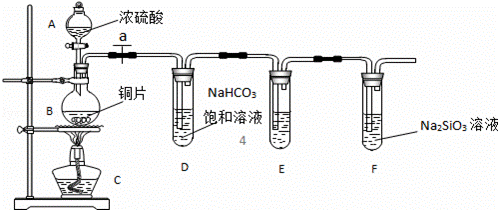
填写所示仪器名称A B
(2)实验步骤:
连接仪器、 、加药品后,打开a、然后滴入浓硫酸,加热.
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是 ;装置E中足量酸性KMnO4溶液(具有强氧化性)的作用是 ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性 (填“能”或“否”),试管D中发生反应的离子方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com