
【题目】温度为T时,向2VL的密闭容器中充入一定量的A和B,发生反应:![]() ;
;![]() ,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是
,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是

A.反应在前10min的平均反应速率![]()
B.反应至15min时,改变的条件是降低温度
C.若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D.该反应的平衡常数表达式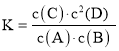
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )

A. 电流从右侧电极经过负载后流向左侧电极
B. 负极发生的电极反应式为N2H4+4OH--4e-===N2↑+4H2O
C. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D. 该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,验证取代反应时,反应需用水浴加热的原因是_____;观察到________现象时,表明溴乙烷与NaOH溶液已完全反应。
(2)有机物A的分子式为C3H8O,它能氧化成B也能与浓硫酸共热生成C。若B不能发生银镜反应,C不能使溴水褪色。B含有的官能团名称为__________,C结构简式为:_____________。
(3)DAP是电器和仪表部件中常用的一种高分子材料,其结构如图:
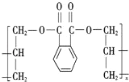
则合成它的单体是________(填序号)。
①邻苯二甲酸 ②丙烯 ③丙烯酸 ④邻苯二甲醇 ⑤丙烯醇
(4)![]() 的名称是(用系统命名法命名)_____________________。
的名称是(用系统命名法命名)_____________________。
(5)写出![]() 与足量溴水反应的化学方程式________。
与足量溴水反应的化学方程式________。
(6)写出 与足量NaOH溶液反应的化学方程式_____。
与足量NaOH溶液反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如下图所示:

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是________;b的名称是________;
(2)a中发生主要反应的化学方程式为____________________________;本实验最容易产生的有机副产物的结构简式为________。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加人无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
(3)用碳酸钠溶液洗涤的作用是________,操作X的名称为________。
Ⅲ.产物分析及产率计算
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有_______种不同化学环境的氢原子。
② 本实验所得环己烯的产率是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中投入![]() 和
和![]() ,分别在温度
,分别在温度![]() 和
和![]() 下进行如下反应:
下进行如下反应:![]() ,且在
,且在![]() 温度下反应一段时间后改变某一个外界条件,测得
温度下反应一段时间后改变某一个外界条件,测得![]() 的物质的量
的物质的量![]() 与时间
与时间![]() 关系如下表所示,下列有关说法中错误的是( )
关系如下表所示,下列有关说法中错误的是( )
0 | 5min | 10min | 15min | 20min | 25min | |
| 2mol |
|
|
|
|
|
| 2mol |
|
|
|
|
|
A.![]()
B.![]()
C.![]() 温度下15min时改变的条件可能是加入一定量的He
温度下15min时改变的条件可能是加入一定量的He
D.![]() 温度下的平衡常数为12.96
温度下的平衡常数为12.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,碳酸、醋酸和亚硫酸的电离平衡常数见下表:
名称 | 碳酸 | 醋酸 | 亚硫酸 |
电离常数(298K) | K1=4.4×10–7 K2=4.7×10–11 | K=1.8×10–5 | K1=1.3×10–2 K2=6.2×10–8 |
(1)298K时,碳酸、醋酸和亚硫酸,从强到弱的顺序_______________________.(用化学式表示)
(2)用离子方程式表示Na2SO3溶液显碱性的原因_______________________。
(3)25℃时,相同浓度的CH3COONa溶液的碱性________Na2CO3溶液的碱性(填“>”“<”或“=”)。
(4)向醋酸溶液中加少量NaOH溶液,醋酸的电离平衡常数________(填“增大”、“减小”、“不变”).
(5)已知常温下:某NaHSO3溶液的pH=5,则该NaHSO3溶液中c(H2SO3) ________ c(SO32-)(填“>”“<”或“=”).
(6)25℃时,PH=4的亚硫酸溶液与PH=10的NaOH溶液等体积混合后,溶液显_________性.
A.酸性 B.碱性 C.中性 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2l恒温恒容容器中加入2molMgSO4并充入 2molCO,发生反应:MgSO4(s)+ CO(g)![]() MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
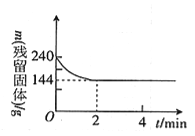
A. 0 ~2min内平均反应速率v(SO2)= 0.3 mol·l-1 ·min-1
B. 2 ~4min内容器内气体的密度没有变化
C. 该温度下,反应的平衡常数为1.8
D. 保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 molCO,反应达到平衡时,n(CO2)> 0.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO与H2合成甲醇,CO(g)+2H2(s)![]() CH3OH(g) △H=—90.8kJ/mol。300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
CH3OH(g) △H=—90.8kJ/mol。300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
容量 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 molCO、2molH2 | 1mol CH3OH | 2mol CH3OH | |
平衡时数据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ | |
体系压强(Pa) | P1 | P2 | P3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法正确的是
A.2c1>c3B.a+b<90.8C.2P2<P3D.a1+a3<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉与水蒸气反应的装置如图所示,有关该反应的说法正确的是( )

A.该反应属于复分解反应
B.网罩的作用是集中火焰,提高温度
C.湿棉花的作用是给试管降温,防止炸裂
D.铁与水蒸气在高温下的反应产物为Fe2O3和H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com