
 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末•,溶于浓盐酸会生成HCuC12,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末•,溶于浓盐酸会生成HCuC12,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:分析 (1)①装置A为固液不加热型,用选用二氧化锰作催化剂,分解双氧水或者过氧化钠与水制备氧气;②装置B为加热固体的装置,可选用分解氯酸钾和高锰酸钾制备氧气;
(2)①加热控制温度60~70℃,低于水的温度,采取水浴加热,搅拌可以使反应物充分接触,加快反应速率;
②硝酸具有强氧化性,可以氧化CuCl;
③CuCl是微溶于水,不溶于乙醇,用乙醇洗涤除去杂质,减小溶解导致的损失;
(3)①加入适量稀硫酸酸化,提高KMnO4的氧化能力;
②由电子转移守恒计算CuCl的物质的量,进而计算CuCl质量分数.
解答 解:(1)①装置A制取氧气的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑(或2Na2O2+2H2O=4NaOH+O2↑);
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑(或2Na2O2+2H2O=4NaOH+O2↑);
②装置B仪器c中应盛放的试剂是KClO3和MnO2(或KMnO4);
故答案为:KClO3和MnO2(或KMnO4);
(2)①加热控制温度60~70℃,低于水的温度,采取水浴加热,受热均匀,便于控制温度,搅拌可以使反应物充分接触,加快反应速率;
故答案为:水浴加热;让反应物充分接触反应,加快反应速率;
②硝酸具有强氧化性,可以氧化CuCl,导致CuCl的产率降低;
故答案为:CuCl的产率降低;
③CuCl是微溶于水,不溶于乙醇,用乙醇洗去固体表面可溶性杂质,减小溶解导致的损失;
故答案为:洗去固体表面可溶性杂质,并减少CuCl溶解的损耗;
(3)①加入适量稀硫酸,提高KMnO4的氧化能力;
故答案为:酸化,提高MnO4-的氧化能力;
②由电子转移守恒:n(CuCl)=5n(KMnO4)=5×0.2000mol•L-1×0.015L=0.015mol,CuCl质量分数为$\frac{0.015mol×99.5g/mol}{1.600g}×100%$=93.28%;
故答案为:93.28%.
点评 本题以制备CuCl的无机工业流程;考查物质制备实验、氧气制备、物质含量测定、氧化还原反应滴定等,注意对题目信息的运用,是对学生综合能力的考查.


科目:高中化学 来源: 题型:解答题

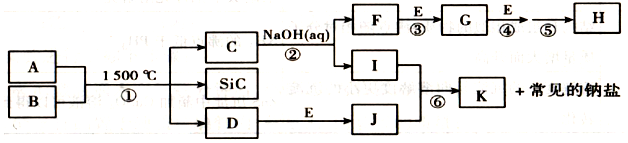
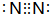 ,G的化学式:NO;
,G的化学式:NO;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| C. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、ClO-、Cl- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
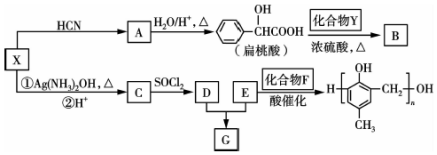
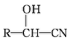 RCHO$→_{△}^{H_{2}O/H+}$
RCHO$→_{△}^{H_{2}O/H+}$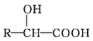
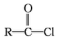 $\stackrel{R'OH}{→}$RCOOR'(R、R'代表烃基)
$\stackrel{R'OH}{→}$RCOOR'(R、R'代表烃基) .
.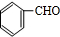 +2Ag(NH3)2OH$\stackrel{水浴△}{→}$
+2Ag(NH3)2OH$\stackrel{水浴△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +
+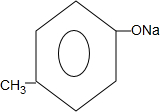 +H2O.
+H2O.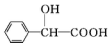 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式:
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式: .
.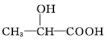 )的路线(其他无机试剂任选).合成路线流程图示例如下:
)的路线(其他无机试剂任选).合成路线流程图示例如下: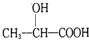 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
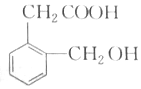 ),B与A互为同分异构体,B满足下列要求的同分异构种类为6种.
),B与A互为同分异构体,B满足下列要求的同分异构种类为6种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把油倒入灶台旁的盆中,炸完食品后可倒回盆中,这样用起来比较方便 | |
| B. | 把油桶悬挂在灶台上,并在油桶上安装一个龙头,这样用起来更方便 | |
| C. | 把油分装在几个干净的玻璃瓶中密封,用完一瓶再用一瓶 | |
| D. | 把油放入一个大塑料桶中,随用随倒,比较省事 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com