
某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
|
| A. | 1:2 | B. | 1:4 | C. | 3:4 | D. | 3:2 |
科目:高中化学 来源: 题型:
在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:
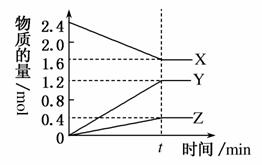
(1)该反应的化学方程式是___________________________。
(2)反应起始至t,Y的平均反应速率是_________________。
(3)X的转化率是_____________________________________。
(4)关于该反应的说法正确的是________。
A.到达t时刻反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在1LK2SO4和CuSO4的混合溶液中,c(SO42﹣)=2.0mol•L﹣1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中K+的物质的量浓度为( )
|
| A. | 2.0mol•L﹣1 | B. | 1.5mol•L﹣1 | C. | 1.0mol•L﹣1 | D. | 0.5mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于次氯酸性质的描述,错误的是( )
|
| A. | 不稳定,易分解放出氧气 | B. | 能使潮湿的有色布条褪色 |
|
| C. | 具有漂白作用和消毒作用 | D. | 是一种比碳酸酸性强的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32﹣)、c(HCO3﹣)都减少,其方法是( )
|
| A. | 通入二氧化碳气体 | B. | 加入氢氧化钠固体 |
|
| C. | 通入氯化氢气体 | D. | 加入饱和石灰水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F、G七种核电荷数小于18的元素,它们的原子序数一次递增.其中:A原子核内无中子,B原子最外层电子数是次外层的2倍,D原子最外层电子数是其电子层数的3倍,E原子核外第一层比第三层电子数多1,F的最外层电子数等于第一层电子数,G形成的﹣1价离子与Ar原子核外电子排布相同;
由此推知:
(1)A原子符号是 ;
(2)B原子结构示意图是
(3)G元素形成的单质与A、D、E三元素形成呈碱性的化合物反应的离子方程式:
单质F分别在C单质、BD元素形成的化合物中燃烧的化学方程式: ; .
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
|
| A. | 电池工作时,锌失去电子 |
|
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e﹣═Mn2O3(s)+2OH﹣(aq) |
|
| C. | 电池工作时,电子由正极通过外电路流向负极 |
|
| D. | 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形 ,该分子是 (填“极性”或“非极性”)分子.
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: .
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) .
(4)f(NH3)5BrSO4可形成两种配合物,已知f3+的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
(5)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
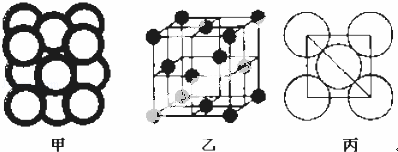
c单质晶体中原子的配位数为 .若已知c的原子半径为r,NA代表阿伏加德罗常数,c的相对原子质量为M.该晶体的密度为 (用字母表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com