
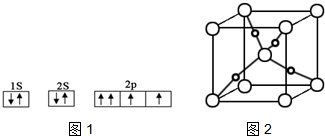
分析 (1)由图1电子轨道排布图可知,2p能级的其中1个轨道2个电子自旋方向相同,违背泡利原理;
(2)Cu2+ 含有空轨道,为中心离子,而NH3中的N原子含有孤对电子,NH3为配体;计算SO42-中S原子的孤对电子数、价层电子对数,确定其空间构型;
(3)甲醇分子间存在氢键,因此其沸点远大于乙烷的;甲醇分子中C原子形成4个σ键,没有孤对电子,杂化轨道数目为4;
(4)根据均摊法可知,晶胞中大球数目为2,小球数目为4,二者数目之比为1:2,由于为Cu2O晶胞的结构,故大球为O原子、小球为Cu原子,结合氧原子配位数确定
解答 解:(1)由图1电子轨道排布图可知,2p能级的其中1个轨道2个电子自旋方向相同,违背泡利不相容原理,
故答案为:错误;违背泡利不相容原理;
(2)Cu2+ 含有空轨道,为中心离子,接受电子,而NH3中的N原子含有孤对电子,NH3为配体;SO42-中S原子的孤对电子数=$\frac{6+2-2×4}{2}$=0、价层电子对数=4+0=4,其空间构型为正四面体,
故答案为:氮原子(或N);Cu2+;正四面体;
(3)甲醇分子间存在氢键,因此其沸点远大于乙烷的;甲醇分子中C原子形成4个σ键,没有孤对电子,杂化轨道数目为4,碳原子采取sp3杂化,
故答案为:甲醇分子间存在氢键,因此其沸点远大于乙烷;sp3;
(4)根据均摊法可知,晶胞中大球数目为8×$\frac{1}{8}$+1=2,小球数目为4,二者数目之比为1:2,由于为Cu2O晶胞的结构,故大球为O原子、小球为Cu原子,氧原子配位数为4,则该晶胞中,Cu+的配位数是2,
故答案为:2.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配合物、杂化方式判断、氢键、晶胞有关计算等,注意掌握判断原子轨道杂化方式的方法,试题培养了学生分析、理解能力及灵活应用能力,题目难度中等.


科目:高中化学 来源: 题型:实验题

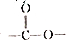 共有6种,其中核磁共振氢谱有3组峰,且锋面积之比为6:1:1的任意一种结构简式为HCOOCH(CH3)2或CH3)2CHCOOH.
共有6种,其中核磁共振氢谱有3组峰,且锋面积之比为6:1:1的任意一种结构简式为HCOOCH(CH3)2或CH3)2CHCOOH.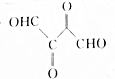 仿照上述题目中工艺图示设计流程为CH2=CHCH=CH2$\stackrel{溴}{→}$CH2BrCHBrCHBrCH2Br$→_{△}^{氢氧化钠溶液}$CH2OHCHOHCHOHCH2OH$→_{铜、△}^{氧气}$
仿照上述题目中工艺图示设计流程为CH2=CHCH=CH2$\stackrel{溴}{→}$CH2BrCHBrCHBrCH2Br$→_{△}^{氢氧化钠溶液}$CH2OHCHOHCHOHCH2OH$→_{铜、△}^{氧气}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 | |
| B. | 淀粉和纤维素水解的最终产物都能发生银镜反应 | |
| C. | 实验时不小心将浓硝酸滴到皮肤上,皮肤表面会变黄 | |
| D. | 动物脂肪发生皂化反应,能生成甘油和高级脂肪酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 平衡时A气体在两容器中体积分数可能相等 | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A>B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | 若x=1,y=3,则达到平衡时反应物的转化率N<M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量叫做中和热 | |
| B. | 在101kPa时,1mol物质燃烧时的反应热叫做该物质的燃烧热 | |
| C. | 对于热化学方程式S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2,化学反应的△H前者大于后者 | |
| D. | 如果反应物所具有的总能量低于生成物所具有的总能量,则发生的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯的制备: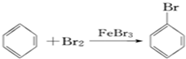 | |
| B. | 1,3-戊二烯发生加聚反应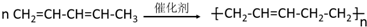 | |
| C. | 苯酚钠溶液中通入少量二氧化碳: | |
| D. | 醇可以制备卤代烃,如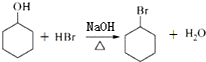 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com