
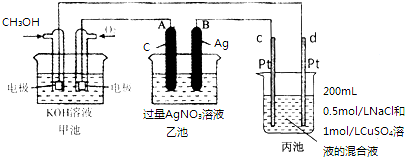
分析 甲池能自发的进行氧化还原反应,属于原电池,通入甲醇的电极为负极、通入氧气的电极为正极,则乙池、丙池是电解池,A、C属于阳极,B、d属于阴极,A电极反应式为氢氧根离子得电子生成氧气,电极反应式为4OH-+4e-=2H2O+O2↑,B极反应式为Ag++e-=Ag、C极反应式为4OH-+4e-=2H2O+O2↑、d极反应式为2Cl--2e-=Cl2↑,据此分析解答.
解答 解:(1)通入甲醇的电极为负极、通入氧气的电极为正极,则乙池、丙池是电解池,A、C属于阳极,碱性条件下,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,总的电极反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,
故答案为:阳极;CH3OH-6e-+8OH-=CO32-+6H2O;2CH3OH+3O2+4KOH=2K2CO3+6H2O;
(2)乙池为电解硝酸银溶液的电解池,生成Ag和氧气,电解方程式为4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,
故答案为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
(3)一段时间后,乙池是放氧生成酸型,所以乙池中的pH值将减小,若要将溶液恢复为原溶液的浓度,应加入AgO或Ag2CO3,
故答案为:减小;AgO或Ag2CO3;
(4)n(Cl-)=0.2×0.5=0.1mol,n(Cu2+)=0.2×1=0.2mol,当电路中通过0.6mol电子时,阴极上生成0.2mol的铜和0.1mol的H2,阳极生成0.05mol的Cl2,和0.125mol的O2,所以气体的体积为:(0.1+0.05+0.125)×22.4=6.16L,氢离子的物质的量为:0.3mol,所以此时丙池中c(H+)为$\frac{0.3mol}{0.2L}$=1.5mol/L,
故答案为:6.16;1.5.
点评 本题考查了电解池的原理应用,电解氢氧化钠溶液,电解硝酸银,电极判断,电极产物分析,电极反应,电子守恒的计算应用,电极判断是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 不同价态锰的微粒的能量(△G)如图.若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒.
不同价态锰的微粒的能量(△G)如图.若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
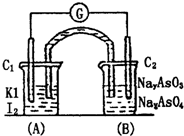 已知反应AsO43-+2I-+H+?AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:
已知反应AsO43-+2I-+H+?AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1:c2=1:3 | B. | 平衡时,Y与Z的生成速率之比为3:2 | ||
| C. | X、Y的转化率不相等 | D. | c1的取值范围0<c1<0.14 molL-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4C2H4C3H4 | B. | CH4C2H6C2H2 | C. | C2H2C2H4C3H6 | D. | C2H4C3H6C4H8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com