
【题目】钛酸钡(BaTiO3)作为著名的铁电和压电材料,因其优异电性能和低污染性受到人们重视,也是目前制备无铅压电陶瓷的重要候选材料。某工厂以重晶石(主要含BaSO4)为原料,生产钛酸钡的工艺流程如图:
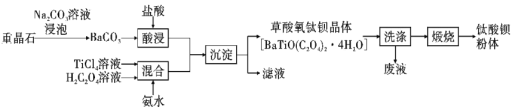
回答下列问题:
(1)酸浸时将BaCO3研成粉末并适当增大盐酸浓度,是为了___;常温下,TiCl4为液体且极易水解,配制一定浓度的TiCl4溶液的方法是__。
(2)用Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K=__(填写计算结果);若不考虑CO32-的水解,要使2.33gBaSO4恰好完全转化为BaCO3,则至少需要浓度为1.0mol·L-1Na2CO3溶液__mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
(3)流程中“滤液"的主要成分为__;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和混合气态产物,试写出反应的化学方程式:__。
【答案】提高BaCO3的酸浸速率 溶于浓盐酸,再加适量蒸馏水稀释至所需浓度 0.02 510 NH4Cl BaTiO(C2O4)2·4H2O![]() BaTiO3+2CO↑+2CO2↑+4H2O
BaTiO3+2CO↑+2CO2↑+4H2O
【解析】
(1)根据物质的存在状态及影响化学反应速率的因素分析;TiCl4是强酸弱碱盐,在溶液中弱碱阳离子水解,从抑制盐水解考虑;
(2)根据沉淀的转化平衡方程式书写、计算;
(3)根据原子守恒判断滤液中的主要成分;草酸氧钛钡晶体隔绝空气煅烧得到BaTiO3,同时得到CO、CO2及水蒸气。
(1)盐酸与BaCO3发生反应:2HCl+BaCO3=BaCl2+H2O+CO2↑,为了加快反应速率可以将固体BaCO3研成粉末,以增大接触面积,故答案为:提高BaCO3的酸浸速率;TiCl4是强酸弱碱盐,在溶液中Ti4+会发生水解反应:Ti4++4H2O![]() Ti(OH)4+4H+,使溶液变浑浊,为了配制得到澄清的TiCl4溶液,同时不引入杂质离子,通常是将TiCl4溶于浓盐酸中,然后再加适量水稀释至所需浓度,故答案为:溶于浓盐酸,再加适量蒸馏水稀释至所需浓度;
Ti(OH)4+4H+,使溶液变浑浊,为了配制得到澄清的TiCl4溶液,同时不引入杂质离子,通常是将TiCl4溶于浓盐酸中,然后再加适量水稀释至所需浓度,故答案为:溶于浓盐酸,再加适量蒸馏水稀释至所需浓度;
(2) 在溶液中BaSO4存在沉淀溶解平衡,当向溶液中加入饱和Na2CO3溶液时,发生沉淀转化生成BaCO3:BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq),待达到平衡后,移走上层清液,重复多次操作,最终BaSO4生成BaCO3;反应的平衡常数
BaCO3(s)+SO42-(aq),待达到平衡后,移走上层清液,重复多次操作,最终BaSO4生成BaCO3;反应的平衡常数 ,故答案为:0.02;2.33gBaSO4物质的量为0.01mol,根据BaSO4(s)+CO32-(aq)
,故答案为:0.02;2.33gBaSO4物质的量为0.01mol,根据BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq),完全转化需要0.01molCO32-,同时溶液中产生0.01molSO42-,根据K值溶液中含有n(CO32-)=0.01mol÷0.02=0.5mol,需要加入Na2CO3为0.01mol+0.5mol=0.51mol,需要Na2CO3溶液的体积为0.51mol÷1mol/L=0.51L=510mL,故答案为:510;
BaCO3(s)+SO42-(aq),完全转化需要0.01molCO32-,同时溶液中产生0.01molSO42-,根据K值溶液中含有n(CO32-)=0.01mol÷0.02=0.5mol,需要加入Na2CO3为0.01mol+0.5mol=0.51mol,需要Na2CO3溶液的体积为0.51mol÷1mol/L=0.51L=510mL,故答案为:510;
(3) TiCl4和草酸混合液加入了氨水,然后与BaCl2溶液混合得到草酸氧钛钡晶体,根据原子守恒,滤液中主要成分为NH4Cl,故答案为:NH4Cl;草酸氧钛钡晶体隔绝空气煅烧得到BaTiO3,同时得到CO、CO2及水蒸气,煅烧草酸氧钛钡晶体得到BaTiO3方程式为BaTiO(C2O4)2·4H2O ![]() BaTiO3+2CO↑+2CO2↑+4H2O,故答案为:BaTiO(C2O4)2·4H2O
BaTiO3+2CO↑+2CO2↑+4H2O,故答案为:BaTiO(C2O4)2·4H2O![]() BaTiO3+2CO↑+2CO2↑+4H2O。
BaTiO3+2CO↑+2CO2↑+4H2O。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】科研人员借助太阳能,将H2S转化为可再利用的S和H2的工作原理如图所示。下列叙述错误的是( )
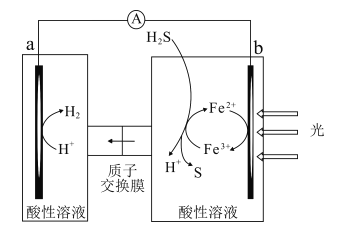
A.该电池能实现将光能转化为化学能
B.a电极的电极反应:2H++2e-=H2↑
C.光照后,b电极的电极反应:H2S-2e-=2H++S
D.a电极区溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)-空气电池工作时反应为:4VB2 +11O2![]() 4B2O3 +2V2O5 。用该电池为电源,选用惰性电极电解一定量的硫酸铜溶液,实验装置如图所示。当电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标况),则下列说法中正确的是
4B2O3 +2V2O5 。用该电池为电源,选用惰性电极电解一定量的硫酸铜溶液,实验装置如图所示。当电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标况),则下列说法中正确的是
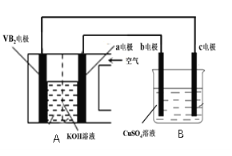
A. VB2电极发生的电极反应为: 2VB2+11H2O – 22e![]() V2O5+2B2O3+22H+
V2O5+2B2O3+22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中,b电极表面先有红色物质析出,然后有气泡产生
D. 若B装置内的液体体积为200mL,则CuSO4溶液的浓度为0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用电解法处理含镍酸性废水并得到单质![]() 的原理如图所示。下列说法不正确的是( )
的原理如图所示。下列说法不正确的是( )
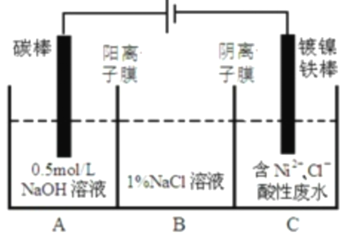
已知:①![]() 在弱酸性溶液中发生水解;②氧化性:
在弱酸性溶液中发生水解;②氧化性:![]() (高浓度)
(高浓度)![]() (低浓度)。
(低浓度)。
A.电解过程中,B中![]() 溶液的物质的量浓度将不断增大
溶液的物质的量浓度将不断增大
B.碳棒上发生的电极反应:![]()
C.为了提高![]() 的产率,电解过程中需要控制废水的
的产率,电解过程中需要控制废水的![]()
D.该装置中电子的流向:电源负极→阴极→阳极→电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化磷![]() 和三氯氧磷
和三氯氧磷![]() ,是两种重要的化工原料。
,是两种重要的化工原料。
(1)实验室制备![]() 的装置图(如图)和有关信息如下:
的装置图(如图)和有关信息如下:
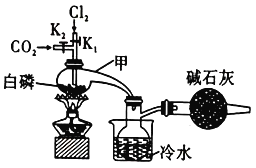
物质 | 熔点/℃ | 沸点/℃ | 密度 | 性质 |
白磷 | 44.1 | 280.5 | 1.82 | 湿空气中约40℃着火 |
|
| 74.2 | 1.574 | 无色液体,遇水均剧烈水解,互溶 |
| 2.0 | 105.3 | 1.675 |
①实验开始先打开![]() 通入
通入![]() 排除装置内空气的目的是______________________。
排除装置内空气的目的是______________________。
②实验制得的粗产品中含有![]() ,可用_______方法提纯。
,可用_______方法提纯。
③![]()
![]() 和
和![]() ,水解后的溶液中除
,水解后的溶液中除![]() 之外其他离子的浓度由大到小的顺序是___________________________________(已知
之外其他离子的浓度由大到小的顺序是___________________________________(已知![]() 是二元弱酸)。
是二元弱酸)。
(2)实验室通常用![]() 直接氧化
直接氧化![]() 制备
制备![]() ,工业上通常采用潮湿的
,工业上通常采用潮湿的![]() 氧化
氧化![]() 制备
制备![]() ,请写出工业制备的反应方程式:______________________________________。从原理上分析,实验室制备方法的优点是_________________________________________________(写出两点)。
,请写出工业制备的反应方程式:______________________________________。从原理上分析,实验室制备方法的优点是_________________________________________________(写出两点)。
(3)用![]() 标准溶液定量测定实验室制备的
标准溶液定量测定实验室制备的![]() 粗产品的纯度,实验步骤如下:
粗产品的纯度,实验步骤如下:
①取![]() 粗产品溶于水至完全水解,预处理排除磷酸根离子的影响,加入
粗产品溶于水至完全水解,预处理排除磷酸根离子的影响,加入![]() 溶液,完全反应后加少量硝基苯,用力摇动,静置,使沉淀表面被有机物覆盖,防止实验测得的
溶液,完全反应后加少量硝基苯,用力摇动,静置,使沉淀表面被有机物覆盖,防止实验测得的![]() 纯度___________(填“偏大”“偏小”或“不变”)。[已知:
纯度___________(填“偏大”“偏小”或“不变”)。[已知:![]() ]
]
②滴加![]() 作指示剂,用
作指示剂,用![]() 溶液滴定过量的
溶液滴定过量的![]() 溶液,当溶液__________________________,即为终点。共用去
溶液,当溶液__________________________,即为终点。共用去![]() 溶液,则粗产品中
溶液,则粗产品中![]() 的纯度为_________%(保留小数点后1位)。
的纯度为_________%(保留小数点后1位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是( )

A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.反应一段时间以后,阴极室NaOH溶液浓度增大,阳极室H2SO4浓度增大
C.当电路中通过3mol电子时,可得到1molH3BO3
D.电解过程中,B(OH)4-穿过阴膜进入产品窒,Na+穿过阳膜进入阴极室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=﹣akJmol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
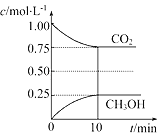
(1)能说明该反应已达平衡状态的是________(填编号)。
A.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
(2)若要使K=1,则改变的条件可以是________(填选项)。
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加入催化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙可由如下反应得到
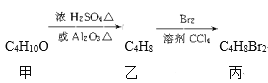
丙的结构简式不可能是( )
A. CH3CH(CH2Br)2B. (CH3)2CBrCH2Br
C. C2H5CHBrCH2BrD. CH3(CHBr)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
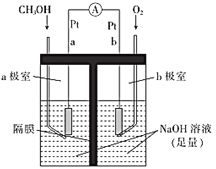
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2 )在催化剂的作用下合成甲醇,可能发生的反应如下:
i. CO2(g)+ 3H2(g)![]() CH3OH(g)+ H2O(g) △H1=QkJ·mol- 1
CH3OH(g)+ H2O(g) △H1=QkJ·mol- 1
ii. CO2(g)+ H2(g)![]() CO(g)+ H2O(g) H2=+41 kJ·mol- 1
CO(g)+ H2O(g) H2=+41 kJ·mol- 1
iii. CO(g)+2H2(g)![]() CH3OH(g) H3=-99 kJ·mol- 1
CH3OH(g) H3=-99 kJ·mol- 1
回答下列问题:
(1)Q=______________
(2)反应iii的化学平衡常数K3=_____________(填表达式)。
(3)图中能正确反映平衡常数K3随温度变化关系的曲线为_____(填字母),理由是_______

(4)如图为单位时间内CO2+H2、CO+ H2、CO/CO2+H2三个条件下生成甲醇的物质的量浓度与温度的关系(三个条件下通入的CO、CO2和H2的物质的量浓度相同)。
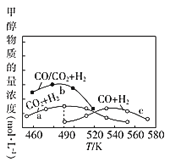
①490K时,根据曲线a、c判断合成甲醇时主要发生的反应为______________(填"i ”或" iii");由曲线a可知,甲醇的量先增大后减小,其原因是__________。
②曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应i、ii分析原因:__________。
(5)如图是以NaOH溶液为电解质溶液的甲醇燃料电池:电极a的反应式为__________, 若隔膜为阳离子交换膜,则每转移6 mol电子,溶液中有___mol Na+向___(填“正极区”或“负极区”)移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com