
一定温度下,难溶强电解质的饱和溶液中存在着沉淀溶解平衡,其平衡常数为
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25℃) | 8.0×10﹣16 | 2.2×10﹣20 | 4.0×10﹣38 |
对于含Fe2(SO4)3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,说
法错误的是
A. 向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B. 向溶液中加入双氧水,并用CuO粉末调节pH,过滤后可获较纯净的CuSO4溶液
C. 该溶液中c(SO42﹣):[c(Fe3+)+c(Fe2+)+c(Cu2+)]=5:4
D. 将少量FeCl3粉末加入含Cu(OH)2的悬浊液中,其中c(Cu2+)增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
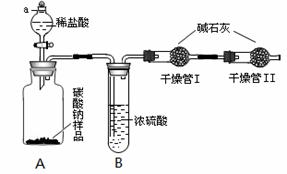 某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了下图所示装置和实验方案。实验步骤如下:
某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了下图所示装置和实验方案。实验步骤如下:
①按图将仪器组装好并检查气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的
质量(设为m1);③准确称量纯碱样
品的质量(设为n),放入广口瓶A
内;④打开分液漏斗a的旋塞,缓缓
滴入稀盐酸,至不再产生气泡为止;
⑤称量干燥管Ⅰ的质量(设为m2)。
(1)实验操作④要缓缓地进行,其理
由是________________。如果操作太快,会导致测定结果________(填偏大、偏小或不变)。(2)装置B的作用是_____________________;干燥管Ⅱ的作用是___________________。(3)根据甲同学的实验数据,写出计算纯碱样品纯度的公式_______________________
(4)方案评价:乙同学认为甲同学的方案有缺陷。乙同学认为稀盐酸要改为稀硫酸,否则
会导致测定结果偏大。你认为还有其它缺陷吗?如果有,提出你的改进意见或需要添加的实
验步骤,并指出甲同学缺少这一步骤会对结果产生什么影响(填偏大、偏小或不变),将答
案填入表中(不一定要填满)。
| 序号 | 改进意见 | 缺少时的影响 |
| ① | ||
| ② | ||
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度、相同浓度下的六种盐溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别为( )
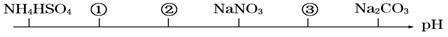
A.NH4Cl (NH4)2SO4 CH3COONa B.(NH4)2SO4 NH4Cl CH3COONa
C.(NH4)2SO4 NH4Cl NaOH D.CH3COOH NH4Cl (NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
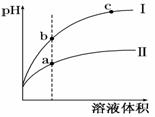
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示.据图判断正确的是( )
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:I2+2S2O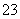 ===S4O
===S4O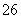 +2I-
+2I-
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入____ ____,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=__ ______。过滤后,将所得滤液低温蒸发、浓缩结晶,可得CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用化学方程式表示)_________________ ____________。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是_________ ___________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用______ __作滴定指示剂,滴定终点的现象是__________________ ____。
②CuCl2溶液与KI反应的离子方程式为__________ ________________。
③该试样中CuCl2·2H2O的质量百分数为____ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度
D.升高温度 E.加入催化剂
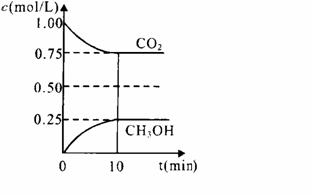
(2)某甲醇燃料电池原理如图1所示。
①M区发生反应的电极反应式为_______________________________。
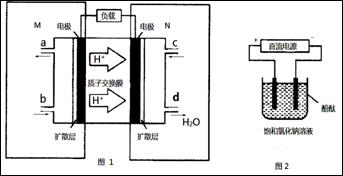
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列3种有机化合物 A:CH2=CH2 B: C:CH3COOH
C:CH3COOH
(1)写出化合物A、C中官能团的名称 、______________;
(2)3种化合物中能使溴的四氯化碳溶液褪色的是 (写名称);反应的化学方程为: ;具有特殊气味、常做有机溶剂的是 (写名称)。
(3)3种化合物中能与NaOH发生中和反应的是 (写名称) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) 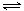 Ca2+(aq)+2OH–(aq),向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
Ca2+(aq)+2OH–(aq),向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
A.溶液中Ca2+离子数目减少 B.溶液中c(Ca2+)增大
C.溶液的pH增大 D.溶液中溶质的质量分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com