分析:(1)图象分析可知是逆反应速率增大,反应是否达到平衡不知,所以增大逆反应速率的因素均符合;
(2)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(3)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念就是得到,通过计算浓度商和平衡常数比较分析判断反应进行的方向;
(4)①根据
计算速率;
②燃料原电池中,负极上燃料失电子发生氧化反应;先根据化合价判断生成N
2O
5的电极,再根据离子的放电顺序写出电极反应式.
解答:
解:(1)图象分析可知是逆反应速率增大,反应是否达到平衡不知,所以增大逆反应速率的因素均符合,如加压、增加甲醇浓度、升高温度、使用催化剂等,
故答案为:加压;增加甲醇浓度、使用催化剂等;
(2)判断反应达到平衡状态的依据正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
A.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故A正确;
B.当反应达到平衡状态时,v(H
2)(逆)=2v(CO)(正),故B错误;
C.容器内CO、H
2、CH
3OH的浓度之比为1:2:1,和起始量,变化量有关,不能作为平衡的标志,故C错误;
D.反应达到平衡状态时,CH
3OH、CO、H
2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故D正确;
E.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故E错误;
故选AD;
(3)在一定温度下,若将4a mol H
2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,
CO(g)+2H
2(g)?CH
3OH(g)
起始量(mol/L) a 2a 0
变化量(mol/L)50%×a a 0.5a
平衡量(mol/L)0.5a a 0.5a
则该反应的平衡常数K=
=
;
若此时再向该容器中投入a mol CO、2a mol H
2和a mol CH
3OH,浓度为c(CO)=
mol/L+0.5amol/L=amol/L,c(H
2)=
mol+amol/L=2amol,c(CH
3OH)=
mol/L+0.5amol/L=amol/L,Q=
=
<K=
,判断平衡移动的方向是反应正向进行,
故答案为:
;正向;
①因为△c(NO
2)=2×(5.00-3.52)mol?L
-1=2.96mol?L
-1,500s内NO
2的平均生成速率为
=0.00592 mol?L
-1?s
-1,故答案为:0.00592 mol?L
-1?s
-1;
②燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H
2+CO
32--2e
-=CO
2+H
2O;
N
2O
5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N
2O
5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H
++2e
-=H
2↑的反应,则阳极为N
2O
4+2HNO
3-2e
-=2N
2O
5+2H
+.
故答案为:H
2+CO
32--2e
-=CO
2+H
2O;N
2O
4+2HNO
3-2e
-=2N
2O
5+2H
+.





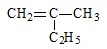
 的名称
的名称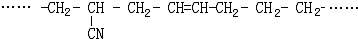 则合成它的单体是
则合成它的单体是