
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L己烷中含有分子数目为NA
B. 1mol/LNaOH溶液中含有Na+数目为NA
C. 7.8gNa2O2中含有的共价键数目为0.1NA
D. 将0.5molN2O4充入密闭容器中充分反应转化成NO2的数目为NA
科目:高中化学 来源: 题型:
【题目】近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O![]() KIO3+3H2↑.下列有关说法正确的是( )
KIO3+3H2↑.下列有关说法正确的是( )
A. 电解时,石墨作阴极,不锈钢作阳极 B. 电解时阳极反应是:I﹣﹣6e﹣+3H2O=IO3﹣+6H+
C. 溶液调节至强酸性,对生产有利 D. 电解后溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验。请你参与并完成对有关问题的解答:
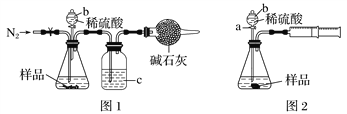
(1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸是与样品中的__________(填“Na2CO3”或“NaCl”)发生反应,仪器b的名称是__________,洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是____________________。
(2)乙同学用图2所示装置,取一定质量的样品m g和足量稀硫酸反应进行实验,完成样品中Na2CO3质量分数的测定。
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的___________________,则装置气密性良好。
②在实验完成时,能直接测得的数据是CO2的______(填“体积”或“质量”)。
(3)丙同学用下图所示方法和步骤进行实验:

①操作Ⅰ涉及的实验名称有:__________、洗涤;操作Ⅱ涉及的实验名称有干燥、__________。
②丙同学测得样品中Na2CO3的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是________腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:_______________
II.在如图用石墨作电极的电解池中,放入500mL饱和NaCl溶液并滴入酚酞,进行电解,观察到B电极附近溶液先变红。请回答下列问题:
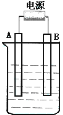
(1)A接的是电源的_______极,B是该装置______。
(2)写出电解时总反应的离子方程式:____________________________ 。
(3)电解后溶液的pH______ ;(填 增大、减小或不变)要使电解后溶液恢复到电解前的状态,则需加入_______ 。
(4)若电源为碱性锌锰干电池,负极为______ 正极为______ 电解质溶液是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义.
(1)海水中无机碳的存在形式及分布如下图所示:
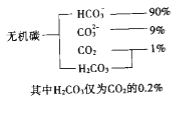
用离子方程式表示海水呈弱碱性的原因______________.已知春季海水pH=8.1,预测夏季海水碱性将会_____________(填写“增强”或“减弱”),理由是_________________________.
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) △H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇.如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.下列说法正确的是_______________.
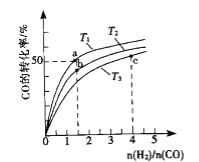
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5 mol co和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 mol co和4mol H2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
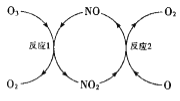
①NO的作用是___________________。
②已知:O3(g)+0(g)=202(g) △H=-143kJ·mol-l
反应1: O3(g)+NO(g)NO2(g)+O2(g) △H1=-200.2kJ·mol-l
反应2:热化学方程式为_____________________。
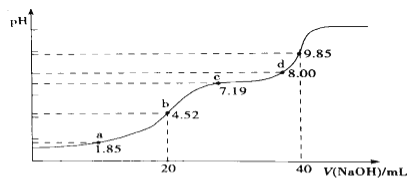
(4)大气污染物SO2可用NaOH吸收.已知pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。该温度下用0.1mol· L-1 NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示.b点所得溶液中各离子浓度由大到小的顺序是________________;c点所得溶液中:c(Na+)___________3c(HSO3-)(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡,根据要求回答下列问题:
(1)向 ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象 _______________________________________________ 。
(2)AlCl3溶液蒸干并灼烧得到的物质是__________ (填化学式)。
(3)0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为_____________。
(4)0.1mol·L-1的NaHA溶液中,粒子浓度由大到小的顺序为:c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中显________(填“酸性”、“碱性”或“中性”);
②作出上述判断的依据是___________________________________________(用文字解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将金属钠置于空气中加热,可以观察到有淡黄色固体生成,试写出该反应的方程式:__________________________________。
(2)在实验室模拟侯氏制碱法制备碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气(NH3)达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体和氯化铵溶液。该过程的总的化学方程式为:____________________________________________。
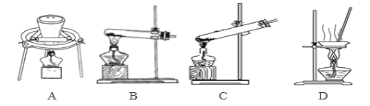
(3)加热NaHCO3得到纯碱制品,实验室进行此操作的装置可以是_____________(填选项)。
(4)某实验小组通过下列实验探究过氧化钠与水的反应:
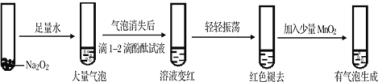
加入MnO2后,反应的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
(2) 以KOH溶液为电解质溶液,依据题(1)所选反应设计一个原电池,其负极的电极反应式为_______。
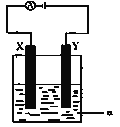
(3) 电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为___________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的c(H+) = _____(假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E 是中学常见的 5 种化合物,A、B 是氧化物,它们之间的转化关系如图所示。
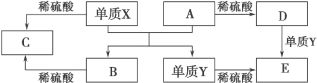
则下列说法正确
A. 单质 Y 在一定条件下能与水发生置换反应
B. 检验 D 溶液中金属阳离子的反应:Fe3++3SCN-===Fe(SCN) 3↓
C. 单质 X 与 A 反应的化学方程式:Al2O3+2Fe![]() Fe2O3+2Al
Fe2O3+2Al
D. 由于化合物 B 和 C 均既能与酸反应,又能与碱反应,所以两者均是两性化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com