
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量氢氧化钠;③加适量盐酸;④加足量碳酸钠溶液;⑤加过量氯化钡溶液。下列操作顺序正确的是
A. ①④②⑤③ B. ④①②⑤③ C. ④②⑤①③ D. ⑤②④①③
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子轨道的叙述中正确的
A.氢原子的2s轨道能量较3p轨道高
B.能层n=4的原子轨道最多可容纳16个电子
C.p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道也在增多
D.锂原子的2s与5s 轨道皆为球形分布
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用蒸馏水稀释1mol/L的醋酸溶液至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A. c(H+)/c(CH3COOH) B. c(CH3COOH)/c(H+)
C. n(CH3COOH)/c(CH3COO-) D. c(CH3COO-)c(H+)/c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3∶1∶2,则溶液中Al3+ 和SO42-的离子个数比为
A. 1∶2 B. 1∶4 C. 3∶4 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对温室气体CO2进行减排和综合治理具有重要意义。回答下列问题:
Ⅰ. O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。

(1)电池的负极反应式:______________________________________________ 。电池的正极反应式:6O2+6e![]() 6O2 ;6CO2+6O2
6O2 ;6CO2+6O2![]() 3C2O42 + 6O2
3C2O42 + 6O2
(2)反应过程中O2的作用是________。
(3)该电池的总反应式:_________________________________。
Ⅱ. CH4-CO2催化重整不仅对温室气体的减排具有重要意义,还可以得到合成气(CO和H2)。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1 =+206.2 kJ/mol K1
②CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH2 = +165.0 kJ/mol K2
(4)写出该催化重整反应的热化学方程式__________________________________________。
K=_________(用 K1 、K2表示)
(5)恒温恒压下,向容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,此时体积为2 L,一段时间后达到平衡时,CO2的转化率是50%,其平衡常数为_______。
(6)分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体让其发生催化重整反应。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
(7)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
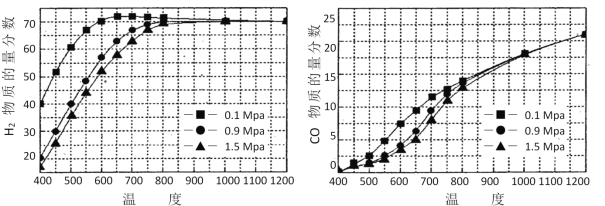
若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是___。
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5Mpa D.1000℃,1.5MPa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是

A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl2 6H2O的流程如下:
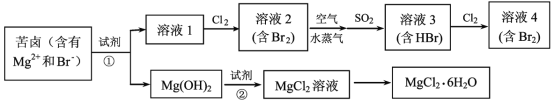
(1)写出一种海水淡化的方法_____。
(2)比较溶液中Br2的浓度:溶液2_____溶液4(填“>”或“<”)。
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是_______。
(4)试剂①可以选用__________,加入试剂②后反应的离子方程式是_________。
(5)从MgCl2溶液获得MgCl2 6H2O晶体的主要操作包括_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com