

分析 (1)根据题目信息、氧化还原反应中化合价发生变化确定产物以及电子得失守恒和质量守恒来配平;根据反应中电子转移数目可计算出参加反应的氯气的物质的量;
(2)根据生产工艺流程图,第①步氯气过量,第③步需要碱性条件,在温度较高时KOH 与Cl2 反应生成的是KClO3,氧化还原反应中化合价有升有降;
(3)根据题目信息、氧化还原反应中化合价发生变化确定产物以及电子得失守恒和质量守恒来配平;
(4)检验最后一次的洗涤中无Cl-即可;
(5)根据氧化还原反应电子得失守恒配平;
解答 解:(1)据题目信息、氧化还原反应中化合价发生变化确定产物有:KClO3、KCl、H2O,根据电子得失守恒和质量守恒来配平,可得6KOH+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O,根据方程可知,每3mol氯气参加反应则有5mol电子发生转移,
故答案为:6KOH+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O;3;
(2)A、根据生产工艺流程图,第①步氯气过量,加入KOH固体后会继续反应生成KClO,故A正确;
B、因温度较高时KOH 与Cl2 反应生成的是KClO3,而不是KClO,故B错误;
C、第③步需要碱性条件,所以碱要过量,故C正确;
D、KClO3转化为 KClO,化合价只降不升,故D错误;
故选:A、C;
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)因只要检验最后一次的洗涤中无Cl-,即可证明K2FeO4晶体已经洗涤干净,所以操作为用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净,
故答案为:用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净;
(5)根据电子得失守恒和质量守恒来配平,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,
故答案为:4、10、4、3、8OH-.
点评 本题结合高铁酸钾(K2FeO4)的制备主要考查了氧化还原反应的知识、离子的检验等,培养了学生运用知识的能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Cu2+、Na+、SO42- | |
| B. | 加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| C. | 强酸性溶液中:Fe2+、Al3+、NO3-、Cl- | |
| D. | 酚酞试液显红色的溶液中:Ba2+、Na+、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液中加入过量NaOH溶液:HCO3-+OH-═H2O+CO2 | |
| B. | 向次氯酸钠溶液中通入少量二氧化碳:2ClO-+H2O+CO2═2HClO+CO32- | |
| C. | 向乙二酸(H2C2O4)溶液中滴入少量氢氧化钠溶液:H2C2O4+2OH-═C2O42-+2H2O | |
| D. | 向氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 该反应的化学方程式为3X(g)+Y(g)?2Z(g) | |
| C. | 25℃时,该反应的平衡常数为1600 | |
| D. | 改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
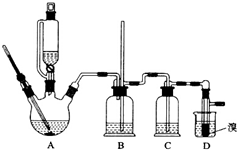 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是物质的数量单位 | |
| B. | 58.5 gNaCl溶解在1 L水中,得到溶液的物质的量浓度为1mol/L | |
| C. | 标况下,1 mol CCl4 所占的体积约为22.4 L | |
| D. | 12g12C含有的碳原子数约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4s时c(B)为0.76mol/L | |
| B. | 830℃达平衡时,A的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com