
 N2+2CO2。
N2+2CO2。 N2(g)+2CO2(g)反应的平衡常数的表达式为:
N2(g)+2CO2(g)反应的平衡常数的表达式为: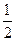 O2(g)=2CO2(g) △H=一283 kJ/mol
O2(g)=2CO2(g) △H=一283 kJ/mol N2(g)+2CO2(g)△H= kJ/mol。
N2(g)+2CO2(g)△H= kJ/mol。 N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是 。
N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是 。 出行
出行 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:不详 题型:填空题
|
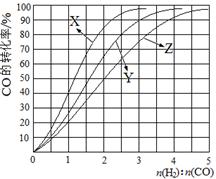
 H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题: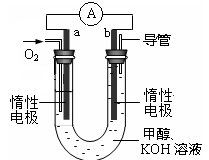
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向纯水中加入盐酸使水的电离平衡逆向移动,水的离子积不变 |
| B.NH3(g)+HCl(g)==NH4Cl(s)△H<0,低于一定温度自发,高于一定温度非自发 |
| C.铅蓄电池在放电过程中,负极质量减少,正极质量增加 |
| D.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
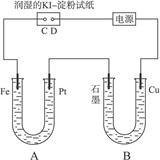
科目:高中化学 来源:不详 题型:单选题
| A.碳棒上有气体放出,溶液的pH增大 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,电子从a极流到b极 |
| D.a极上发生了氧化反应 |
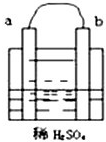
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
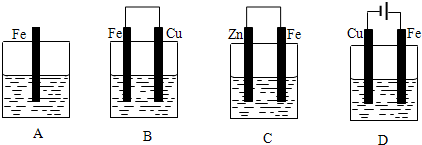
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。 O(g)△H2=-1160 kJ·mol-1
O(g)△H2=-1160 kJ·mol-1 (2)脱碳。将CO2转化为甲醇的热化学方程式为:
(2)脱碳。将CO2转化为甲醇的热化学方程式为: CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3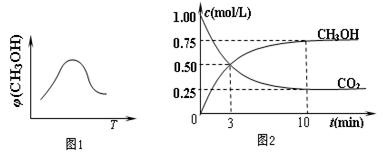
 器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图2所示。下列说法正确的是 (填字母代号)。
器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图2所示。下列说法正确的是 (填字母代号)。| A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)="1.5" mol/L |
| B.0~10 min内,氢气的平均反应速率为0.075 mol/(L·min) |
| C.达到平衡时,氢气的转化率为0.75 |
| D.升高温度将使n(CH3OH)/n(CO2)减小 |
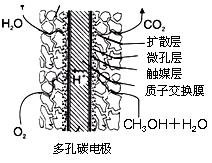
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸起始温度、NaOH起始温度和反应后的终止温度 |
| B.由“C(石墨)=C(金刚石);△H=" +119" kJ/mol ”可知金刚石比石墨稳定 |
| C.在稀溶液中: H++OH-=H2O;△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
| D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H= +285.8kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com