
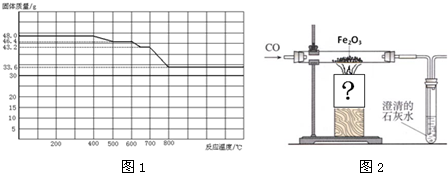
| ||
| ||


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
| A、三者的单质均为银白色固体 |
| B、三者都能与盐酸、稀硫酸反应 |
| C、AlCl3、FeCl3、CuCl2均可作净水剂 |
| D、制备Al 用电解法,制备Fe、Cu可用还原法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 代号 | a | b | c | d | e |
| 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只含Na2CO3 |
| B、只含NaHCO3 |
| C、NaOH和Na2CO3的混合物 |
| D、Na2CO3和NaHCO3的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有1,3-丁二烯和氢气的混合气体5L,在催化剂作用下,经充分反应后得到的气体体积为VL(所有体积均在同温、同压下测定).
有1,3-丁二烯和氢气的混合气体5L,在催化剂作用下,经充分反应后得到的气体体积为VL(所有体积均在同温、同压下测定).查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z三种物质与W之间存在如图转化关系,当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2,则满足上述条件的X、Y可能是( )
X、Y、Z三种物质与W之间存在如图转化关系,当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2,则满足上述条件的X、Y可能是( )| A、①④⑤ | B、①②③ |
| C、①③④ | D、①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com