
【题目】下列各种基态原子的核外电子排布式中,正确的是( )。
A. 1s22s12p2 B. 1s22s22p33s1
C. 1s22s22p63s14s1 D. 1s22s22p63s23p64s1
科目:高中化学 来源: 题型:
【题目】霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=_______________________,T1℃时,该反应的平衡常数K=____________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_______(填字母)。
a.升高温度 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30 min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q__________(填“>”、“=”或“<”)0。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
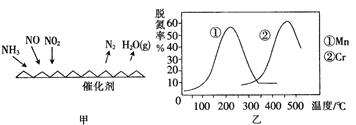
①由图甲可知,SCR技术中的氧化剂为_______________。已知c(NO2):c(NO)=1:1时脱氮效果最佳, 若生成1 mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为__________________________
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应温度分别为___________________________。
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。已知常温下Ka1(H2SO3)=1.8×10-2 , Ka2(H2SO3)=6.0×10-9。常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、;石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对 废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ脱硝:
己知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+l33kJ·mol-1
H2O(g)=H2O(l) △H=-44kJ·mol-1
在催化剂存在下,H2还原NO2可生成水蒸气和其它无毒物质的热化学方程式为:____________。
Ⅱ.脱碳:在2L的密闭容器中充入2mo1 CO2和6mol H2,在适当的催化剂作用下发生反应:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H<0
CH3OH(l)+H2O(l) △H<0
①该反应自发进行的条件是___________(填“”低温或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是________(填字母)
a.混合气体的平均摩尔质量保持不变
b. CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d. 混合气体的密度保持不变
e. 1mol CO2生成的同时有3 mul H―H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,请画出t2~t4CO2浓度随时间的变化。______

(2)改变温度,使反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
l0min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
① 达到平衡时,反应I、Ⅱ对比:平衡常数K(I)_____K(Ⅱ)(填“>”“<”或“=”下同);平衡时CH3OH的浓度 c(I)______c(Ⅱ)。
②对反应I,前10min内的平均反应速率v(CH3OH)=_________。在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1________T2(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、技术密切关。下列说法错误的是
A. 某些疫苗等生物制剂要冷冻保存是为了防止蛋白质变性
B. 活性铁粉在食品袋中作“去氧剂”表现的是铁粉的还原性
C. 可在元素周期表中金属与非金属的分界处寻找催化剂和耐高温、耐腐蚀的合金材料
D. 用酚醛树脂为基体合成的增强塑料是复合材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵在加热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是
A. 1:3 B. 2:3 C. 1:1 D. 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种物质既能与强酸反应,又能与强碱反应的是( )
①Al ②AlCl3 ③Na2CO3 ④Al2O3 ⑤NaHCO3
A. ①③⑤ B. ②③④ C. ①③④ D. ①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com