
| A. | HCl、CuCl2、Ba(OH)2 | B. | NaOH、CuSO4、H2SO4 | ||
| C. | Ba(OH)2、H2SO4、K2SO4 | D. | NaBr、H2SO4、Ba(OH)2 |
分析 在惰性电极条件下电解时只生成氢气和氧气,则溶液中氢离子在阴极放电,氢氧根离子在阳极放电,结合离子的放电顺序来解答.
解答 解:A.电解HCl生成氢气和氯气,电解CuCl2生成Cu和氯气,电解Ba(OH)2生成氢气和氧气,故A不选;
B.电解NaOH生成氢气和氧气,电解CuSO4生成Cu、氧气、硫酸,电解H2SO4生成氢气和氧气,故B不选;
C.电解NaOH、H2SO4、Ba(OH)2,均只生成氢气和氧气,故C选;
D.电解NaBr生成溴、氢气、NaOH,电解H2SO4生成氢气和氧气,电解Ba(OH)2生成氢气和氧气,故D不选;
故选C.
点评 本题考查电解原理,明确溶液中离子的放电顺序是解答本题的关键,注意常见的物质的电解及电极材料,题目难度不大.


科目:高中化学 来源: 题型:推断题

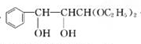 .
. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$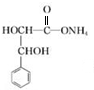 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.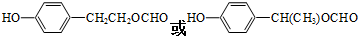 . (任写一种)
. (任写一种)
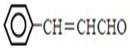 ,设计合成线路(其无机试剂任选),合成线路示意图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=$\stackrel{Br_{2}}{→}$CH2BrH2Br.
,设计合成线路(其无机试剂任选),合成线路示意图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=$\stackrel{Br_{2}}{→}$CH2BrH2Br.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的PH增大 | B. | 溶液中的Zn2+浓度增大 | ||
| C. | 溶液中的SO42- 浓度增大 | D. | 溶液的密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 名称 | 熔点 | 沸点 | 溶解性 |
| 一氯甲烷 | -97.73℃ | -24.2℃ | 18℃时在水中微溶,与乙醚、丙酮或苯互溶,能溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| B. | 开发利用新能源,减少化石燃料的使用 | |
| C. | 过度开采矿物资源,促进地方经济发展 | |
| D. | 加强对工业“三废”的治理,保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2 | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,回答下列问题:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤代烃中卤原子的检验:先加NaOH溶液,加热,冷却后加AgNO3溶液 | |
| B. | 除去乙烷中混有的乙烯,可用酸性KMnO4溶液洗气 | |
| C. | 碳原子数小于10,且一氯代物只有一种的烷烃有3种 | |
| D. | 可用水鉴别苯和四氯化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com