
分析 (1)As所含质子数为33,原子核外电子数为33;
(2)根据价层电子对互斥理论确定AsH3的分子空间构型;
(3)根据等电子体是指具有相同价电子总数和原子总数的分子或离子来回答;
(4)由晶胞结构可知,晶胞中Ga原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、As原子数目=4,以此确定化学式;
(5)根据其密度、晶胞边长计算每个晶胞中含有的铝原子个数,根据铝原子个数判断晶体类型.
解答 解:(1)As所含质子数为33,原子核外电子数为33,根据能量最低原则、泡利不相容原理和洪特规则写出为[Ar]3d104s24p3,
故答案为:[Ar]3d104s24p3;
(2)AsH3中As原子含有3个σ键和1个孤电子对,所以AsH3为三角锥型,中心原子周围三个σ键和一对孤对电子对,所以是sp3杂化,
故答案为:三角锥;sp3;
(3)砷化氢含有4个原子,且价层电子数为11,则与H3O+互为等电子体,故答案为:H3O+;
(4)由晶胞结构可知,晶胞中Ga原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、As原子数目=4,故该化合物化学式为GaAs,故答案为:GaAs;
(5)根据密度公式可得N(Al)×$\frac{27}{40{5}^{3}}$×10-30×6.02×1023=2.70,由此解得每个晶胞中含有的原子数N(Al)=4.00,∴其晶胞的类型面心立方晶胞;
在面心立方晶胞中,每个面的对角线上三个原子紧挨着,所以对角线长度=$\sqrt{2}$×405pm,对角线为四个Al原子半径之和,所以每个铝原子半径=$\frac{\sqrt{2}×405pm}{4}$=143pm,故答案为:面心立方;143.
点评 本题考查了晶胞的计算、原子核外电子排布式的书写、晶体类型的判断等知识点,为高考常见题型,侧重考查学生的分析能力和计算能力,根据构造原理、密度公式、晶体类型与熔沸点的关系来分析解答,难点的晶胞的计算,注意:面心离子分别中,每个面对角线上三个原子紧挨着,而不是每个棱上两个原子紧挨着,为易错点.


科目:高中化学 来源: 题型:选择题
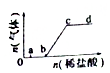 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- | |
| C. | c点对应的溶被中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、H2SO4、S | B. | 金刚石、Na3PO4、Mg | ||
| C. | HF、SiC、Ar | D. | H2O、SiO2、K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 性状 | 相对分 子质量 | 溶解度 | |||
| 冷水 | 热水 | 乙醇 | 乙醚 | |||
| 呋喃甲醛 | 无色液体 | 96 | 微溶 | 易溶 | 易溶 | 互溶 |
| 呋喃甲醇 | 无色液体 | 98 | 互溶 | 互溶 | 易溶 | 易溶 |
| 呋喃甲酸 | 无色晶体 | 112 | 微溶 | 易溶 | 可溶 | 易溶 |
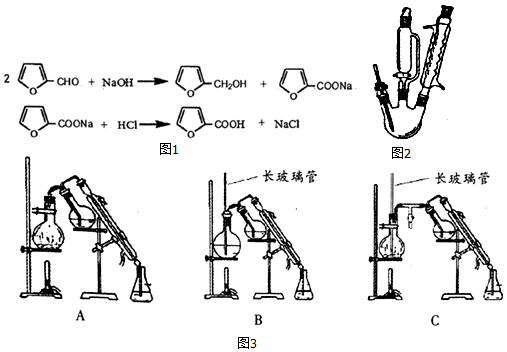
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 短周期元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的热稳定性:H2T<H2R | |
| B. | 单质与稀盐酸反应的速率:L<Q | |
| C. | 离子半径:R2-<L2+ | |
| D. | M与T形成的化合物既能与强酸反应,又能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
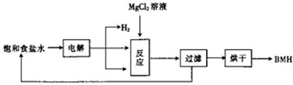 BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.
BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com