
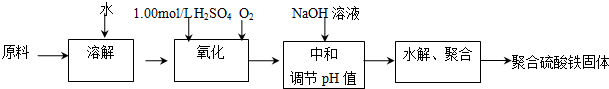
分析 (1)①配制一定物质的是浓度的溶液要称量溶质的质量,用容量瓶定容;
②硫酸亚铁在酸性条件下被氧气氧化成硫酸铁;
(2)硫酸过多,在后面调节pH时要消耗的氢氧化钠的量就多,造成浪费;
(3)①采用重量法测定碱式硫酸铁(x Fe2O3•y SO3•z H2O)中x、y、z的值时,可以将样品溶于氢氧化钠溶液,根据得到的固体氧化铁的质量确定x的值,过滤,在所得滤液中加氯化钡,根据产生的硫酸钡沉淀的质量可确定y的值,根据样品的总质量结合Fe2O3和计算得的SO3的质量可确定z的值;
②根据①的分析可知,要测定Fe2O3、BaSO4的质量;
(4)测定过程中将样品溶于氢氧化钠溶液,经过过滤、洗涤、烘干或灼烧、冷却、称量得氧化铁的质量,在所得滤液中加氯化钡,经过过滤、洗涤、烘干或灼烧、冷却、称量得硫酸钡的质量,据此答题.
解答 解:(1)①配制一定物质的是浓度的溶液要称量溶质的质量,要用电子天平,用容量瓶定容,
故答案为:电子天平、容量瓶;
②硫酸亚铁在酸性条件下被氧气氧化成硫酸铁,反应的离子方程式为4Fe2++O2+4H+4Fe3++2H2O,
故答案为:4Fe2++O2+4H+4Fe3++2H2O;
(2)硫酸稍过量是为了防止Fe3+水解成氢氧化铁,当硫酸过多时,后续中和需要的碱的用量力大,造成浪费,所以加入的硫酸比理论值稍多,但不能过多,
故答案为:硫酸稍过量是为了防止Fe3+水解成氢氧化铁,当硫酸过多时,后续中和需要的碱的用量力大,造成浪费;
(3)①采用重量法测定碱式硫酸铁(x Fe2O3•y SO3•z H2O)中x、y、z的值时,可以将样品溶于氢氧化钠溶液,根据得到的固体氧化铁的质量确定x的值,过滤,在所得滤液中加氯化钡,根据产生的硫酸钡沉淀的质量可确定y的值,根据样品的总质量结合Fe2O3和计算得的SO3的质量可确定z的值,故选a c;
②根据①的分析可知,要测定Fe2O3、BaSO4的质量,
故答案为:Fe2O3、BaSO4;
(4)测定过程中将样品溶于氢氧化钠溶液,经过过滤、洗涤、烘干或灼烧、冷却、称量得氧化铁的质量,在所得滤液中加氯化钡,经过过滤、洗涤、烘干或灼烧、冷却、称量得硫酸钡的质量,故选aed.
点评 本题考查物质的分离和提纯,侧重考查学生获取信息及利用信息能力、分析能力、实验操作能力,注意题给信息的灵活运用,知道常见离子的检验方法及现象,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14g一氧化碳所占体积为11.2 L | |
| B. | 等物质的量的Na2O2和Na2O中所含阴阳离子总数相等 | |
| C. | NO的摩尔质量为30g | |
| D. | 常温常压下32g臭氧中含有的氧原子数目比标准状况下22.4L氧气中含有的氧原子数目少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
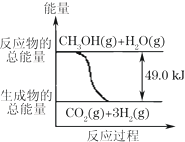 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:| A. | 1molCH3OH完全燃烧放热192.9kJ | |
| B. | 反应①中的能量变化如右图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$ O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 充电时,Li0.85NiO2只发生氧化反应 | |
| C. | 该电池不能用水溶液作为电解质 | |
| D. | 放电过程中Li+向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com