
2013年以来,全国很多地区都曾陷入严重的雾霾和污染天气中,冬季取暖排放的CO2、汽车尾气等都是形成雾霾的因素。
(1)已知:① N2(g) + O2(g)=2NO(g) △H=+179.5 kJ/mol
②2NO(g) + O2(g)=2NO2(g) △H=-112.3 kJ/mol
③2NO(g) +2CO(g)=N2(g) +2CO2(g) △H=-759.8 kJ/mol
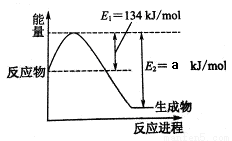
下图是在101kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化的示意图。则a= 。
(2)将不同物质的量的H2O(g)和CO分别通入体积为2L的恒容密闭容器中,进行反应:
H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
1 | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
3 | 900 | a | b | c | d | t |
①实验组1中以v(CO2)表示的反应速率为 ,此温度下的平衡常数为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、 1mol CO、 1 mol CO2和 x molH2,若要使反应在开始时正向进行,则x应满足的条件是 。
③若a=2,b=1,则达平衡时实验组2中H2O(g)和实验组3中CO的转化率的关系为α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
(14分)(1)368(3分)(2)① 0.16mol/(L·min) (2分) 8/3或2.67 (2分)减少 (2分) ② 0≤x<16/3 (3分) ③ =(2分)
【解析】
试题分析:(1)抑制① N2(g) + O2(g)=2NO(g) △H=+179.5 kJ/mol 、②2NO(g) + O2(g)=2NO2(g) △H=-112.3 kJ/mol、③2NO(g) +2CO(g)=N2(g) +2CO2(g) △H=-759.8 kJ/mol,则根据盖斯定律可知(①-②+③)÷2即得到反应NO2(g)+CO(g)=NO(g) +CO2(g) △H=-234kJ/mol。则根据图像可知134kJ/mol-a kJ/mol=-234kJ/mol,解得a=368。
(2)①根据表中数据可知平衡时生成氢气的物质的量是1.6mol,则根据方程式可知消耗CO2的物质的量是1.6mol,其浓度是0.8mol/L,则CO2表示的反应速率为0.8mol/L÷5min=0.16mol/(L·min)。
② H2O(g)+CO(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度 1mol/L 2mol/L 0 0
转化浓度 0.8mol/L 0.8mol/l 0.8mol/l 0.8mol/l
平衡浓度 0.2mol/L 1.2mol/L 0.8mol/l 0.8mol/l
所以平衡常数K=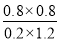 =2.67
=2.67
根据表中1、2数据可知,实验1中CO的转化率为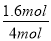 ×100%=40%,实验2中CO的转化率为
×100%=40%,实验2中CO的转化率为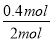 ×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,因此平衡常数减小;
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,因此平衡常数减小;
②若要使反应在开始时正向进行,则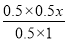 <2.67,解得x<16/3,因此x的取值范围是0≤x<16/3。
<2.67,解得x<16/3,因此x的取值范围是0≤x<16/3。
②实验2条件下平衡常数,需要列式计算平衡浓度
H2O(g)+CO(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
则K=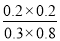 =0.17
=0.17
若a=2,b=1,则
H2O(g)+CO(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度 1 0.5 0 0
转化浓度 x x x x
平衡浓度 1-x 0.5-x x x
则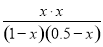 =0.17
=0.17
解得x=0.2
所以在这两种情况下实验组2中H2O(g)和实验组3中CO的转化率均是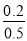 ×100%=40%。
×100%=40%。
考点:考查反应热、反应速率、平衡常数的有关计算与应用以及外界条件对平衡状态的影响


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
实验测得BeCl2为共价化合物,两个Be—Cl键间的夹角为180°,以下判断正确的是( )
A.由极性键构成的极性分子 B.由极性键构成的非极性分子
C.由非极性键构成的极性分子 D.BeCl2中Be采取sp2杂化
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省五校高三第三联考理综化学试卷(解析版) 题型:实验题
已知:ICl的熔点为13.90C,沸点为97.40C,易水解,且能发生反应:ICl(l)+ Cl2(g)=ICl3(l)

(1)装置A中发生反应的化学方程式是____________ 。
(2)装置B的作用是______。不能用装置F代替装置E,理由____________ 。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是______ (填标号)。
A.过滤 B.蒸发结晶 C.蒸馏 D.分液
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度。进行如下两个实验,实验过程中有关反应为:
①
②ICl+KI=I2+KCl
③I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将5.00g该油脂样品溶于四氯化碳后形成100mL溶液,从中取出十分之一,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol.L-1的Na2S2O3 标准溶液滴定。经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL。
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL。
①滴定过程中可用______ 作指示剂。
②滴定过程中需要不断振荡,否则会导致V1______ (填“偏大”或“偏小)。
③5.00g该油脂样品所消耗的ICl的物质的量为__ mol。由此数据经换算即可求得该油脂的不饱和度。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省五校高三第三联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在加热、甲醛、饱和(NH4)2SO4溶液、X射线作用下,蛋白质都会发生变性
B.氨基酸、蛋白质、油脂都含有C、H、O、N四种元素
C.生活中食用的食醋、植物油、动物蛋白等物质都是混合物
D.乙烯、聚乙烯、苯均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省东北三省高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列化学用语表述正确的是
A.CH3COONH4的电离方程式为: CH3COONH4 CH3COO?+NH4+
CH3COO?+NH4+
B.NaHS的水解方程式为: HS?+H2O S2?+H3O+
S2?+H3O+
C.用过量的氨水吸收SO2的离子方程式为: 2NH3·H2O + SO2 =2NH4+ + SO32?+H2O
D.过量Fe粉与Cl2反应的化学方程式为: Fe +Cl2 FeCl2
FeCl2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省玉门市高三第三次摸底考试化学试卷(解析版) 题型:填空题
某化学小组对SO2与漂白粉的反应进行实验探究,实验过程如下:取10克漂白粉固体,加入250mL水中,部分固体溶解溶液略有颜色,过滤后用洁净的玻璃棒沾取滤液到pH试纸上,发现pH试纸先变蓝(约为12)后褪色.回答下列问题:
(1)工业制取漂白粉的化学方程式是 __ ,漂白粉在空气中变质的原因 (用化学反应方程式说明)
(2)pH试纸颜色的变化说明漂白粉溶液具有的性质是 ,ClO2和漂白粉一样也具有强氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的 倍;
(3)将SO2持续通入漂白粉溶液中,发现澄清透明的溶液先变为黄绿色,随后溶液中产生大量白色沉淀且黄绿色褪去。回答下列问题:
①澄清透明溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂白粉的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 ;
②用离子方程式解释现象中黄绿色褪去的原因: ;
③SO2与漂白粉的有效成分在酸性条件下反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省玉门市高三第三次摸底考试化学试卷(解析版) 题型:选择题
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2=3CO2 +N2O。下列关于N2O的说法一定正确的是
A.上述反应中,每消耗2mol NO2,就会生成22.4L N2O
B.N2O有氧化性,且为HNO2的酸酐
C.等质量的N2O和CO2含有相等的电子数
D.N2O会迅速与人体血红蛋白结合,使人中毒
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省十三校高三第二次联考理综化学试卷(解析版) 题型:选择题
向CuS04溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通人S02气体,溶液逐渐变成无色。下列分析正确的是
A.滴加KI溶液时,转移2 mol e一时生成1 mol白色沉淀
B.通入S02后溶液逐渐变成无色,体现了S02的漂白性
C.通入S02时,S02与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>I2>S02
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com