
| A. | 溶液的 pH 逐渐增大 | B. | 溶液中的 c(OH-)逐渐减小 | ||
| C. | 醋酸的电离程度逐渐增大 | D. | 溶液的导电能力逐渐减小 |
分析 醋酸是弱电解质,加水稀释后促进醋酸电离,电离平衡正向进行,由于氢离子增大的量远远小于水增加的体积,导致氢离子浓度减小;由于温度不变,则水的离子积不变,故氢氧根离子浓度增大,据此进行解答.
解答 解:A.温度不变,水的离子积常数不变,加水稀释促进醋酸的进电离,电离平衡正向进行,氢离子增大的量远远小于水增加的体积,导致氢离子浓度减小,溶液pH增大,故A正确;
B.加水稀释,促进醋酸电离,但氢离子增大的个数远远小于水增加的体积,所以氢离子浓度降低,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,故B错误;
C.稀释后醋酸浓度减小,醋酸的电离程度增大,故C正确;
D.醋酸被稀释后,溶液中醋酸根离子、氢离子浓度减小,导致溶液导电性减弱,故D正确;
故选B.
点评 本题考查弱电解质的电离平衡及其影响,题目难度不大,明确弱电解质的电离特点及水的离子积常数只与温度有关即可解答,易错选项为A,很多同学认为“加水稀释促进醋酸电离,氢离子个数增大,所以其浓度增大,溶液pH减小”,忽略了溶液体积的变化而导致错误,为易错点;试题培养了学生的分析能力及综合应用用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-3-戊炔 | B. | 4-甲基-1,3-戊二烯 | ||
| C. | 2-甲基-2-戊炔 | D. | 2-甲基-3-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
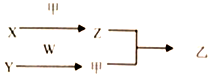 短周期元素A、B、C、D的原子序数依次增加.X、Y、Z、W分別是由这四种元素中的两种组成的常见化合物,甲为单质,乙为红棕色气体,Y为淡黄色固体.上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中正确的是( )
短周期元素A、B、C、D的原子序数依次增加.X、Y、Z、W分別是由这四种元素中的两种组成的常见化合物,甲为单质,乙为红棕色气体,Y为淡黄色固体.上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中正确的是( )| A. | 原子半径:D>C>B>A | |
| B. | C、D的氢化物均为共价化合物 | |
| C. | 相对分子质量W>X,沸点W>X | |
| D. | B的氢化物常温下一定为气态,C的氢化物常温下为液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| W | Q | M |
| A. | 对应氢化物的沸点Y>Q是因为Y的非金属性比Q强 | |
| B. | XM4的比例模型为  其二氢取代物有两种 其二氢取代物有两种 | |
| C. | W的氧化物,常温下可以和Z、M的氢化物反应 | |
| D. | Z的单质能将Y的单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此反应不属于化学变化 | |
| B. | 112 号元素的相对原子质量为 227 | |
| C. | 科学家合成的 112 号元素的原子的中子数为 165 | |
| D. | 112 号元素属于第七周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
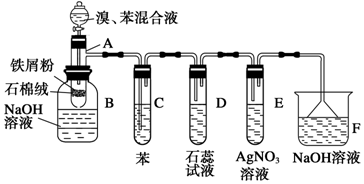
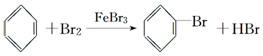
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
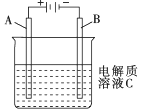 (1)肼(N2H4)又称联氨,是一种可燃性液体,可用作燃料.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,反应生成一种可以参与大气循环的气体.该电池放电时,负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑.
(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作燃料.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,反应生成一种可以参与大气循环的气体.该电池放电时,负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com