
| A. | MgCl2 | B. | HCl | C. | H2O | D. | NaOH |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族(H元素除外)、第IIA族元素和第VIA族、第VIIA族元素之间易形成离子键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键.
解答 解:A.氯化镁中镁离子和氯离子之间中存在离子键,为离子化合物,故A错误;
B.HCl分子中H-Cl原子之间只存在共价键,为共价化合物,故B错误;
C.水分子中H-O原子之间只存在共价键,为共价化合物,故C错误;
D.NaOH中钠离子和氢氧根离子之间存在离子键、H-O原子之间存在共价键,为离子化合物,故D正确;
故选D.
点评 本题考查化学键判断,为高频考点,明确离子键和共价键概念及其区别是解本题关键,注意A中两个氯离子之间不存在化学键,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
下列属于电解质并能导电的物质是
A.淀粉 B.KNO3 溶液 C.FeC13 晶体 D.熔融的Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未知浓度酸液用滴定管量取,滴定管用蒸馏水洗涤后,没用待测酸液润洗 | |
| B. | 装待测液的锥形瓶用蒸馏水洗涤后,没用待测液冲洗 | |
| C. | 量取酸液的体积时,开始仰视凹液面,取液结束时俯视凹液面 | |
| D. | 滴定开始滴定管尖端有气泡,到达终点时尖端无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 增加FeS2的量 | B. | 增大O2的浓度 | C. | 升高温度 | D. | 减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2s | B. | 5 s | C. | 10 s | D. | 20 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA元素的电负性从上到下逐渐减小,ⅦA元素的第一电离能从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | NaH的存在能支持可将氢元素放在ⅦA的观点 | |
| D. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
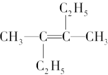 的命名正确的是( )
的命名正确的是( )| A. | 2,3-二乙基-2-丁烯 | B. | 2,3-二乙基-3-丁烯 | ||
| C. | 3-甲基-2-乙基-2-戊烯 | D. | 3,4-二甲基-3-己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
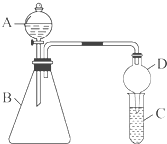 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com