
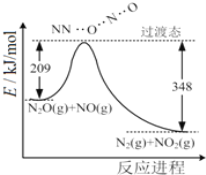
”¾ĢāÄæ”æ£Ø1£©ÓÉN2OŗĶNO·“Ӧɜ³ÉN2ŗĶNO2µÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬ČōÉś³É1molN2£¬Ęä”÷H=___kJ”¤mol-1”£
£Ø2£©ŅŃÖŖ£ŗ¢ŁC(s)+O2(g)=CO2(g) ¦¤H=akJ”¤mol-1
¢ŚCO2(g)+C(s)=2CO(g) ¦¤H=bkJ”¤mol-1
¢ŪSi(s)+O2(g)=SiO2(s) ¦¤H=ckJ”¤mol-1
¹¤ŅµÉĻÉś²ś“Ö¹čµÄČČ»Æѧ·½³ĢŹ½ĪŖ__”£
£Ø3£©ŌŚĢž·Ö×ÓÖŠČ„µō2øöĒāŌ×ÓŠĪ³ÉŅ»øöĖ«¼üŹĒĪüČČ·“Ó¦£¬“óŌ¼Šč117kJ/mol”«125kJ/molµÄČČĮ棬µ«1£¬3”Ŗ»·¼ŗ¶žĻ©Ź§Č„2øöĒāŌ×Ó±ä³É±½ŹĒ·ÅČČ·“Ó¦£¬”÷H=-23.4kJ/mol£¬ŅŌÉĻŹĀŹµ±ķĆ÷±½¼ÓĒāÉś³É»·¼ŗĶéŹĒ__·“Ó¦”££ØĢī·ÅČČ»ņĪüČČ£©
£Ø4£©X”¢YĮ½ŌŖĖŲµÄŌ×Ó£¬µ±ĖüĆĒ·Ö±š»ńµĆĮ½øöµē×ÓŠĪ³ÉĻ”ÓŠĘųĢåŌŖĖŲµē×Ó²ć½į¹¹Ź±£¬X·Å³öµÄČČĮæ“óÓŚY·Å³öµÄČČĮ棻Z”¢WĮ½ŌŖĖŲµÄŌ×Ó£¬µ±ĖüĆĒ·Ö±šŹ§Č„Ņ»øöµē×ÓŠĪ³ÉĻ”ÓŠĘųĢåŌŖĖŲŌ×ӵĵē×Ó²ć½į¹¹Ź±£¬ĪüŹÕÄÜĮæW“óÓŚZ”£ŌņX”¢YŗĶZ”¢W·Ö±šŠĪ³ÉµÄ»ÆŗĻĪļÖŠ£¬Ąė×Ó»ÆŗĻĪļæÉÄÜŠŌ×ī“óµÄŹĒ__”££ØĢī»ÆŗĻĪļµÄ»ÆѧŹ½£©
£Ø5£©³ĘČ”µČÖŹĮæĪŖ(ag)µØ·ÆĮ½·Ż”£°ŃŅ»·ŻČÜÓŚbgĖ®ÖŠ£¬²āÖŖĘäČܽāŹ±ĪüŹÕQ1kJČČĮ棻°ŃĮķŅ»·ŻĶŃĖ®ŗóČÜÓŚbgĖ®ÖŠ£¬²āµĆĘäČܽāŹ±·ÅČČQ2kJ”£“ÓŅŌÉĻŹż¾ŻæÉÖŖ£¬1molµØ·ÆĶŃĖ®Šč__kJČČĮ攣
”¾“š°ø”æ-139 2C(s)+ SiO2(s)= Si(s)+ 2CO(g) ¦¤H=£Ø2a+b-c£©kJ”¤mol-1 ·ÅČČ Z2X ![]()
”¾½āĪö”æ
(1)ÓÉĶ¼Ź¾æÉÖŖ·“Ó¦²śÉś1molµŖĘųĪŖ·ÅČČ¹ż³Ģ£¬·Å³öµÄČČĮæĪŖ348kJ-209kJ=139kJ£¬Ōņ·“Ó¦ČČ”÷H=-139 kJ”¤mol-1£¬¹Ź“š°øĪŖ£ŗ-139”£
(2) ¹¤ŅµÖĘ“Ö¹čµÄ·“Ó¦ĪŖ£ŗ2C(s)+ SiO2(s)= Si(s)+ 2CO(g)£¬ÓÉøĒĖ¹¶ØĀÉæÉÖŖ£ŗøĆ·“Ó¦=![]() £¬Ōņ”÷H=£Ø2a+b-c£©kJ”¤mol-1£¬ČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ2C(s)+ SiO2(s)= Si(s)+ 2CO(g) ¦¤H=£Ø2a+b-c£©kJ”¤mol-1£¬¹Ź“š°øĪŖ£ŗ2C(s)+ SiO2(s)= Si(s)+ 2CO(g) ¦¤H=£Ø2a+b-c£©kJ”¤mol-1”£
£¬Ōņ”÷H=£Ø2a+b-c£©kJ”¤mol-1£¬ČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ2C(s)+ SiO2(s)= Si(s)+ 2CO(g) ¦¤H=£Ø2a+b-c£©kJ”¤mol-1£¬¹Ź“š°øĪŖ£ŗ2C(s)+ SiO2(s)= Si(s)+ 2CO(g) ¦¤H=£Ø2a+b-c£©kJ”¤mol-1”£
(3)ÓÉĢāŅāæÉÖŖ£ŗ![]() £¬ÓÉ»·¼ŗĶé×Ŗ±ä³É±½Õūøö¹ż³ĢŹĒĪüŹÕČČĮæµÄ£¬ŌņÓɱ½µ½»·¼ŗĶéµÄ¹ż³ĢĪŖ·ÅČČ¹ż³Ģ£¬¹Ź“š°øĪŖ£ŗ·ÅČČ”£
£¬ÓÉ»·¼ŗĶé×Ŗ±ä³É±½Õūøö¹ż³ĢŹĒĪüŹÕČČĮæµÄ£¬ŌņÓɱ½µ½»·¼ŗĶéµÄ¹ż³ĢĪŖ·ÅČČ¹ż³Ģ£¬¹Ź“š°øĪŖ£ŗ·ÅČČ”£
(4) X”¢YĮ½ŌŖĖŲµÄŌ×Ó£¬µ±ĖüĆĒ·Ö±š»ńµĆĮ½øöµē×ÓŠĪ³ÉĻ”ÓŠĘųĢåŌŖĖŲµē×Ó²ć½į¹¹Ź±£¬X·Å³öµÄČČĮæ“óÓŚY·Å³öµÄČČĮæ,ĖµĆ÷X±ČYÄÜĮæŅŖøߣ¬X±ČY»īĘĆ£»Z”¢WĮ½ŌŖĖŲµÄŌ×Ó£¬µ±ĖüĆĒ·Ö±šŹ§Č„Ņ»øöµē×ÓŠĪ³ÉĻ”ÓŠĘųĢåŌŖĖŲŌ×ӵĵē×Ó²ć½į¹¹Ź±£¬ĪüŹÕÄÜĮæW“óÓŚZ£¬ĖµĆ÷W±ČZÄŃŹ§µē×Ó£¬ŌņZ±ČW»īĘĆ£¬»īĘĆµÄ½šŹōŌŖĖŲÓė»īĘƵķĒ½šŹōŌŖĖŲøüŅ׊Ī³ÉĄė×Ó¼ü£¬Ąė×Ó»ÆŗĻĪļæÉÄÜŠŌ×ī“óµÄŹĒZ2X£¬¹Ź“š°øĪŖ£ŗZ2X”£
(5)ÓÉĢāŅā£ŗagµØ·ÆČÜÓŚbgĖ®ÖŠ£¬ĪüŹÕQ1kJČČĮ棬Ōņ1molµØ·ÆČܽāĪüČČĪŖ£ŗ![]() ,ŌņČܽāŹ±µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ
,ŌņČܽāŹ±µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ![]() £¬ĶŃĖ®ŗóČÜÓŚbgĖ®ÖŠ£¬²āµĆĘäČܽāŹ±·ÅČČQ2kJæɵĆ
£¬ĶŃĖ®ŗóČÜÓŚbgĖ®ÖŠ£¬²āµĆĘäČܽāŹ±·ÅČČQ2kJæɵĆ![]() £¬1molµØ·ÆĶŃĖ®µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ
£¬1molµØ·ÆĶŃĖ®µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ![]() £¬ÓÉøĒĖ¹¶ØĀÉæÉµĆ£ŗ
£¬ÓÉøĒĖ¹¶ØĀÉæÉµĆ£ŗ![]() £¬Ōņ1molµØ·ÆĶŃĖ®ŠčĪüŹÕ
£¬Ōņ1molµØ·ÆĶŃĖ®ŠčĪüŹÕ![]() µÄČČĮ棬¹Ź“š°øĪŖ£ŗ
µÄČČĮ棬¹Ź“š°øĪŖ£ŗ![]() ”£
ӣ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø»ņ±ķŹ¾·½·ØÕżČ·µÄŹĒ( )
A. Čō½«µČĮæµÄĮņÕōĘųŗĶĮņ¹ĢĢå·Ö±šĶźČ«Č¼ÉÕ,ŗóÕ߷ųöČČĮæ¶ą
B. ÓÉC(ŹÆÄ«)=C(½šøÕŹÆ)¦¤H=+1.9 kJ”¤mol-1æÉÖŖ,½šøÕŹÆ±ČŹÆÄ«ĪȶØ
C. ŌŚ101kPaŹ±,2g H2ĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®,·Å³ö285.8kJČČĮæ,ĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½±ķŹ¾ĪŖ2H2(g)+O2(g)![]() 2H2O(l) ¦¤H=+285.8 kJ”¤mol-1
2H2O(l) ¦¤H=+285.8 kJ”¤mol-1
D. ŌŚĻ”ČÜŅŗÖŠ:H++OH-![]() H2O ¦¤H=-57.3 kJ”¤mol-1,Čō½«ŗ¬1mol CH3COOHÓėŗ¬1mol NaOHµÄČÜŅŗ»ģŗĻ,·Å³öµÄČČĮæŠ”ÓŚ57.3 kJ
H2O ¦¤H=-57.3 kJ”¤mol-1,Čō½«ŗ¬1mol CH3COOHÓėŗ¬1mol NaOHµÄČÜŅŗ»ģŗĻ,·Å³öµÄČČĮæŠ”ÓŚ57.3 kJ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķŹĒ²»Ķ¬ĪĀ¶ČĻĀµÄĄė×Ó»żŹż¾Ż£ŗ
ĪĀ¶Č(”ę) | 25 | t1 | t2 |
Ė®µÄĄė×Ó»ż³£Źż | 1”Į10-14 | ¦Į | 1”Į10-12 |
ŹŌ»Ų“šŅŌĻĀĪŹĢā£ŗ
(1)Čō25<t1<t2£¬Ōņ¦Į____(Ģī”°>”±”¢”°>”±»ņ”°=”±)1”Į10£14£¬×÷³ö“ĖÅŠ¶ĻµÄĄķÓÉŹĒ______”£
(2)ŌŚt1Ź±£¬²āµĆ“æĖ®ÖŠµÄc(H£«)=2.4”Į10£7mol/L£¬Ōņc(OH-)ĪŖ______”£øĆĪĀ¶ČĻĀ£¬²āµĆijH2SO4ČÜŅŗÖŠc(SO42-)=5”Į10£6 mol”¤L£1£¬øĆČÜŅŗÖŠc(OH-)=__mol/L”£
(3)ŌŚŅ»Ģõ¼žĻĀ£¬CH3COOHČÜŅŗÖŠ“ęŌŚµēĄėĘ½ŗā£ŗCH3COOH![]() CH3CH3COO©+H+ ”÷H>0£¬ĻĀĮŠ·½·ØÖŠ£¬æÉŅŌŹ¹0.10mol”¤L©1CH3COOHČÜŅŗÖŠCH3COOHµēĄė³Ģ¶ČŌö“óµÄŹĒ__”£
CH3CH3COO©+H+ ”÷H>0£¬ĻĀĮŠ·½·ØÖŠ£¬æÉŅŌŹ¹0.10mol”¤L©1CH3COOHČÜŅŗÖŠCH3COOHµēĄė³Ģ¶ČŌö“óµÄŹĒ__”£
a.¼ÓČėÉŁĮæ0.10mol”¤L©1µÄĻ”ŃĪĖį b.¼ÓČČ
c.¼ÓĖ®Ļ”ŹĶÖĮ0.010mol/L d.¼ÓČėÉŁĮæ±ł“×Ėį
e.¼ÓČėÉŁĮæĀČ»ÆÄĘ¹ĢĢå f.¼ÓČėÉŁĮæ0.10mol”¤L©1µÄNaOHČÜŅŗ
(4)c(H+)ĻąĶ¬µÄµČĢå»żµÄĮ½·ŻČÜŅŗCH3COOHŗĶHCl£¬·Ö±šÓė×ćĮæµÄŠæ·Ū·“Ó¦£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ__(ĢīŠ“ŠņŗÅ)
a.·“Ó¦ĖłŠčŅŖµÄŹ±¼äCH3COOH>HCl
b.æŖŹ¼·“Ó¦Ź±µÄĖŁĀŹHCl>CH3COOH
c.²Ī¼Ó·“Ó¦µÄŠæ·ŪĪļÖŹµÄĮ涞ÕßĻąµČ
d.CH3COOHĻūŗĵĊæ·ŪµÄÖŹĮæøü¶ą
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫![]() ×Ŗ±äĪŖ
×Ŗ±äĪŖ![]() µÄ·½·ØĪŖ£Ø””””£©
µÄ·½·ØĪŖ£Ø””””£©
A.Óė×ćĮæµÄNaOHČÜŅŗ¹²ČČŗó£¬ŌŁĶØČėCO2
B.ČÜŅŗ¼ÓČČ£¬ĶØČė×ćĮæµÄHCl
C.ÓėĻ”H2SO4¹²ČČŗ󣬼ÓČė×ćĮæµÄNa2CO3
D.ÓėĻ”H2SO4¹²ČČŗ󣬼ÓČė×ćĮæµÄNaOH
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½«ÖŹĮæĪŖmgµÄĶŠ¼ĶźČ«ČÜÓŚŹŹĮæÅØĻõĖįÖŠ£¬·“Ó¦ŗóµĆµ½NO2”¢NOµÄ»ģŗĻĘųĢ壬½«ĖłµĆĘųĢåĶØČė300mL2molL-1NaOHČÜŅŗÖŠ£¬Ē”ŗĆĶźČ«·“Ó¦£¬Éś³Éŗ¬NaNO3ŗĶNaNO2µÄŃĪČÜŅŗ£¬ĘäÖŠNaNO3µÄĪļÖŹµÄĮæĪŖ0.2mol£¬ŌņmµÄÖµĪŖ£Ø £©
A.12.8B.19.2C.25.6D.51.2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijČÜŅŗXÖŠ½öæÉÄÜŗ¬ÓŠ![]() ”¢
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
”¢![]() ÖŠµÄŅ»ÖÖ»ņ¶ąÖÖ£¬ĒŅČÜŅŗÖŠø÷Ąė×ÓÅضČĻąĶ¬”£ĻÖ½ųŠŠĻĀĮŠŹµŃ飬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
ÖŠµÄŅ»ÖÖ»ņ¶ąÖÖ£¬ĒŅČÜŅŗÖŠø÷Ąė×ÓÅضČĻąĶ¬”£ĻÖ½ųŠŠĻĀĮŠŹµŃ飬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ ![]()
![]()
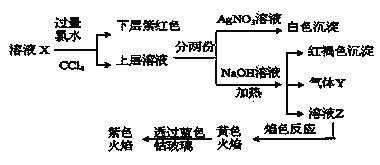
A.øĆČÜŅŗXÖŠæÉÄÜÓŠ![]() ”¢
Ӣ![]()
B.øĆČÜŅŗæÉÄÜÓÉŹĒĮņĖįŃĒĢś”¢µā»Æ¼ŲŗĶĀČ»Æļ§ČÜÓŚĖ®ŗóµĆµ½µÄ
C.Čē¹ūĘųĢåYÄÜŹ¹ŹŖČóµÄĄ¶É«ŹÆČļŹŌÖ½±äŗģ£¬ĖµĆ÷ČÜŅŗÖŠŅ»¶Øŗ¬ÓŠ![]()
D.ȔѳČÜŅŗZ£¬µĪ¼ÓĀČ»Æ±µČÜŅŗ³öĻÖ³Įµķ£¬æÉĶĘ³öXÖŠŅ»¶Ø“ęŌŚ![]() ”¢
”¢![]() ÖŠµÄijŅ»ÖÖ
ÖŠµÄijŅ»ÖÖ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹ“æĢĶÖĘĻßĀ·°åµÄŹ“æĢŅŗÖÖĄąŗܶą£ŗĖįŠŌŹ“æĢŅŗ£¬Čē![]() Ź“æĢČÜŅŗ”¢H2O2-ŃĪĖį¼°CuCl2-ŃĪĖį
Ź“æĢČÜŅŗ”¢H2O2-ŃĪĖį¼°CuCl2-ŃĪĖį![]() ¼īŠŌŹ“æĢŅŗ£¬Čē
¼īŠŌŹ“æĢŅŗ£¬Čē![]() ČÜŅŗµČ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
ČÜŅŗµČ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öĻĀĮŠŹ“æĢŅŗŹ“æĢĶµÄĄė×Ó·½³ĢŹ½”£
¢ŁFeCl3ČÜŅŗ£ŗ_______”£
¢ŚH2O2-ŃĪĖį£ŗ_______”£
¢Ū![]() ČÜŅŗ£ŗ_______
ČÜŅŗ£ŗ_______![]() Éś³É
Éś³É![]() ”£
ӣ
£Ø2£©ĄūÓĆ·Ļ![]() Ź“æĢŅŗ
Ź“æĢŅŗ![]() ŗ¬
ŗ¬![]() ”¢
”¢![]() ¼°
¼°![]() Öʱø¼īŠŌŹ“æĢŅŗ
Öʱø¼īŠŌŹ“æĢŅŗ![]() ČÜŅŗŗĶ
ČÜŅŗŗĶ![]() µÄÖ÷ŅŖ²½Öč°üĄØ£ŗÓĆ
µÄÖ÷ŅŖ²½Öč°üĄØ£ŗÓĆ![]() Ńõ»Æ·ĻŹ“æĢŅŗ£¬ĶØČė°±Ęų
Ńõ»Æ·ĻŹ“æĢŅŗ£¬ĶØČė°±Ęų![]() £¬¹ĢŅŗ·ÖĄė£¬ÓĆŃĪĖįČܽā³ĮµķŗĶ
£¬¹ĢŅŗ·ÖĄė£¬ÓĆŃĪĖįČܽā³ĮµķŗĶ![]() µÄÖʱø”£ĻĀĮŠŹµŃé×°ÖĆ²»ÄÜ“ļµ½ŹµŃéÄæµÄµÄŹĒ_______
µÄÖʱø”£ĻĀĮŠŹµŃé×°ÖĆ²»ÄÜ“ļµ½ŹµŃéÄæµÄµÄŹĒ_______![]() Ģī×ÖÄø
Ģī×ÖÄø![]() ”£
ӣ
A.  Öʱø
Öʱø![]()
B.  Öʱø
Öʱø![]() ²¢³ĮĢś
²¢³ĮĢś
C.  ·ÖĄė
·ÖĄė![]() ČÜŅŗŗĶ
ČÜŅŗŗĶ![]() ³Įµķ
³Įµķ
D.  ½«
½«![]() ČÜŅŗÕōøÉÖʱø
ČÜŅŗÕōøÉÖʱø![]()
£Ø3£©³£ÓĆĖ®ŗĻėĀ![]() »¹Ō·Ø»ŲŹÕCuCl2-ŃĪĖįŹ“æĢŅŗµĆµ½µ„ÖŹĶ£¬ĻČÓĆĒāŃõ»ÆÄĘČÜŅŗÖŠŗĶĘäÖŠĖį²¢½«ČÜŅŗµ÷ÖĮĒæ¼īŠŌ£¬Č»ŗó¼ÓČėĖ®ŗĻėĀµĆÄÉĆ×Ķ£¬øĆŃõ»Æ»¹Ō·“Ó¦ÖŠŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ_______”£
»¹Ō·Ø»ŲŹÕCuCl2-ŃĪĖįŹ“æĢŅŗµĆµ½µ„ÖŹĶ£¬ĻČÓĆĒāŃõ»ÆÄĘČÜŅŗÖŠŗĶĘäÖŠĖį²¢½«ČÜŅŗµ÷ÖĮĒæ¼īŠŌ£¬Č»ŗó¼ÓČėĖ®ŗĻėĀµĆÄÉĆ×Ķ£¬øĆŃõ»Æ»¹Ō·“Ó¦ÖŠŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ_______”£
£Ø4£©ĪÄĻױصĄŅ»ÖÖ»ŲŹÕŹ“æĢ·ĻŅŗÖŠĶ²¢ÖĘČ”µØ·Æ![]() µÄÖ÷ŅŖ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
µÄÖ÷ŅŖ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
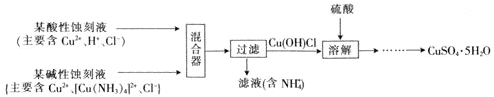
ŅŃÖŖ£ŗ![]() Ņ×ÓėĖį·“Ó¦”£
Ņ×ÓėĖį·“Ó¦”£
![]() ŌŚ»ģŗĻĘ÷ÖŠ£¬
ŌŚ»ģŗĻĘ÷ÖŠ£¬![]() µÄĄė×Ó·½³ĢŹ½ĪŖ_______”£
µÄĄė×Ó·½³ĢŹ½ĪŖ_______”£
![]() ČÜÓŚĮņĖįµÄĄė×Ó·½³ĢŹ½ĪŖ_______”£
ČÜÓŚĮņĖįµÄĄė×Ó·½³ĢŹ½ĪŖ_______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓÉĢ¼ŌŖĖŲ¹¹³ÉµÄø÷ÖÖµ„ÖŹŗĶ»ÆŗĻĪļŹ¼ÖÕ¶¼ŹĒæĘѧ¼ŅŃŠ¾æµÄÖŲŅŖ¶ŌĻó”£
¢ń.¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠæŖ·¢ŗĶÓ¦ÓĆµÄ¹ćĄ«Ē°¾°£¬¹¤ŅµÉĻæÉÓĆ×Ŗ»ÆÖŠµĆµ½µÄŗĻ³ÉĘųÖʱø¼×“¼”£·“Ó¦ĪŖCO(g)+2H2(g)![]() CH3OH(g)£¬Ä³ĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠøĆ·“Ó¦£¬ĘäĻą¹ŲŹż¾Ż¼ūĶ¼£ŗ
CH3OH(g)£¬Ä³ĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠøĆ·“Ó¦£¬ĘäĻą¹ŲŹż¾Ż¼ūĶ¼£ŗ
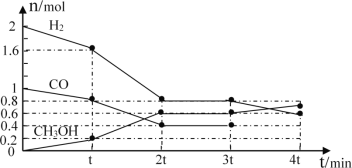
¢Łøł¾ŻĶ¼¼ĘĖć£¬“Ó·“Ó¦æŖŹ¼µ½tminŹ±£¬ÓĆH2ÅØ¶Č±ä»Æ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹ¦Ō(H2)=__”£
¢ŚtminÖĮ2tminŹ±ĖŁĀŹ±ä»ÆµÄŌŅņæÉÄÜŹĒ__£ØŅŖĒó“š³öĖłÓŠæÉÄÜŌŅņ£©”£
¢ņ.Ņ»¶ØĪĀ¶ČĻĀ£¬ĻņŅ»ČŻ»żĪŖ5LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė0.4molSO2ŗĶ0.2molO2£¬·¢Éś·“Ó¦£ŗ2SO2(g)+O2(g)![]() 2SO3(g) ¦¤H=-196kJ”¤mol-1”£µ±·“Ó¦“ļµ½Ę½ŗāŹ±£¬ČŻĘ÷ÄŚŃ¹Ēæ±äĪŖĘšŹ¼Ź±µÄ
2SO3(g) ¦¤H=-196kJ”¤mol-1”£µ±·“Ó¦“ļµ½Ę½ŗāŹ±£¬ČŻĘ÷ÄŚŃ¹Ēæ±äĪŖĘšŹ¼Ź±µÄ![]() ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁSO2µÄ×Ŗ»ÆĀŹĪŖ__£»
¢Ś“ļµ½Ę½ŗāŹ±·“Ó¦·Å³öµÄČČĮæĪŖ__”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÖŠ¹śæĘѧŌŗ³¤“ŗÓ¦ÓĆ»Æѧъ¾æĖłŌŚ¼×“¼(CH3OH)Č¼ĮĻµē³Ų·½¶ų»ńµĆŠĀĶ»ĘĘ£¬ŃŠÖĘ³öĮĖ×ŌŗōĪüµē³Ų¼°Ö÷¶ÆŹ½µē¶Ń”£¼×“¼Č¼ĮĻµē³ŲµÄ¹¤×÷ŌĄķČēĶ¼ĖłŹ¾£ŗ
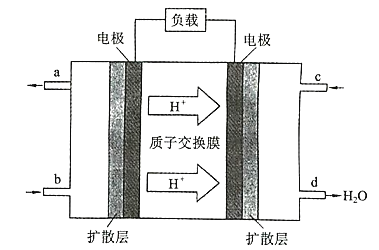
(1)øƵē³Ų¹¤×÷Ź±£¬b“¦ĶØČėµÄĪļÖŹĪŖ ______________ £¬c ĶØČė µÄĪļÖŹĪŖ______”£
(2)øƵē³Ųøŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ _________________ ”£
(3)¹¤×÷Ņ»¶ĪŹ±¼äŗ󣬵±12.8g¼×“¼ĶźČ«·“Ӧɜ³É CO2Ź±Ź±£¬ÓŠ_________”Į6.02”Į1023øöµē×Ó·¢Éś×ŖŅĘ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com