
| A. | 原子半径:X>Y>Z>W | B. | 单质沸点:W>Y>Z | ||
| C. | 简单氢化物的还原性:Y>Z>W | D. | W、X、Z的离子均能促进水的电离 |
分析 短周期元素W、X、Y、Z的原子序数依次增加,W-与Ne具有相同的电子层结构,则W为F;X的族序数等于周期数,则X为Al,Y与Z最外层电子数之和为10,且应为第三周期元素,则Y为Si,Z为S,以此来解答.
解答 解:由上述分析可知,W为F,X为Al,Y为Si,Z为S,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:X>Y>Z>W,故A正确;
B.Si为原子晶体沸点最高,S常温为固体,则单质沸点:Y>Z>W,故B错误;
C.非金属性越强,对应氢化物的还原性越弱,则简单氢化物的还原性:Y>Z>W,故C正确;
D.W、Z的离子为弱酸对应的阴离子,X的离子为弱碱对应的阳离子,均可发生水解反应,则均能促进水的电离,故D正确;
故选B.
点评 本题考查原子结构和周期律,为高频考点,把握原子结构、原子序数、最外层电子数来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 升降机的Al-Mg合金焊接过程中,可采用N2作保护气 | |
| B. | 为降低舰体钢材料中硅含量,冶炼过程中需使用O2和CaCO3 | |
| C. | 为测定螺旋浆Cu-Al合金中铜元素含量,只需使用氨水 | |
| D. | 为防止舰体在海水中发生电化学腐蚀,可镶嵌铜块 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2溶于水:C12+H2O?2H++Cl-+C1O- | |
| B. | 用稀硝酸除去试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| C. | 过量SO2通入饱和的Ca(C1O)2溶液中:Ca2++2ClO-+2SO2+2H2O═CaSO4↓+SO42-+4H++2Cl- | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Fe(OH)2↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{118}^{78}$Pt | B. | ${\;}_{78}^{118}$Pt | C. | ${\;}_{78}^{196}$Pt | D. | ${\;}_{118}^{196}$Pt |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
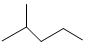 表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.
表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.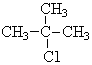 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾易水解生成胶体,可用作净水剂 | |
| B. | 晶体硅熔点高硬度大,可用作芯片 | |
| C. | 氮气化学性质稳定,可用作粮食保护气 | |
| D. | NaClO具有强氧化性,可作织物漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3+H2O→H2SO4 | B. | 2K+2H2O→2KOH+H2↑ | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2Na2O2+2H2O→4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1 CaCl2溶液等体积混合:c(Na+)+c(Ca2+)═c(CH3COO-)+c(CH3COOH)+c(Cl-) | |
| B. | 少量Cl2通入过量泠的0.1 mol•L-1 NaOH溶液中:c(Na+)═c(HClO)+c(ClO-)+c(Cl-) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1 HCl溶液混合至pH=7:c(Na+)>c(Cl-)═c(CH3COOH) | |
| D. | 0.2 mol•L-1 NH3•H2O溶液与0.1 mol•L-1 HCl溶液等体积混合:c(Cl-)+c(H+)═c(NH3•H2O)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com