
| A. | 金刚石>碳化硅>晶体硅 | B. | 邻羟基苯甲酸>对羟基苯甲酸 | ||
| C. | 纯铁>生铁 | D. | MgO>MgCl2 |
分析 一般来说,原子晶体>离子晶体>分子晶体;
组成和结构相似的分子晶体,一般来说相对分子质量越大,分子间作用力越强,熔沸点越高.组成和结构相似的分子晶体,如果分子之间存在氢键,则分子之间作用力增大,有氢键的熔沸点较高.
原子晶体中原子半径越小形成共价键的键长越短,键能就越大,晶体的熔沸点也就越高.
离子的半径越小,所带的电荷越多,则离子键越强,熔沸点越高,
合金的熔沸点低于其成分金属;据此分析.
解答 解:A、三种晶体都为原子晶体,原子晶体熔沸点的高低与共价键的强弱有关.一般来说,半径越小形成共价键的键长越短,键能就越大,晶体的熔沸点也就越高,原子半径大小顺序为Si>C,熔沸点高低顺序为:金刚石>碳化硅>硅,故A正确;
B、邻羟基苯甲酸易形成分子内氢键,对羟基苯甲酸形成分子间氢键,所以邻羟基苯甲酸<对羟基苯甲酸,故B错误;
C、合金的熔沸点低于其成分金属,则纯铁>生铁,故C正确.
D、离子的半径越小,所带的电荷越多,则离子键越强,熔沸点越高,则MgO>MgCl2,故D正确.
故选B.
点评 本题考查不同晶体熔沸点高低的比较,题目难度不大,注意同种晶体和不同晶体熔沸点高低比较的方法和角度,侧重于考查学生对基础知识的应用能力.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
 在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题:
在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有KNO3和Na2CO3,没有Ba(NO3)2 | |
| B. | 肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3 | |
| C. | 肯定没有Na2CO3和Ba(NO3)2,可能有KNO3 | |
| D. | 以上判断都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氨水的反应:H++OH-═H2O | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氯气通入FeCl3溶液中:Cl2+Fe2+═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
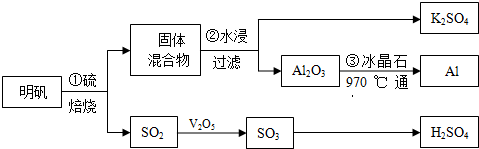
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③⑥ | C. | ②③ | D. | ②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com