
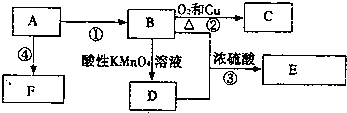

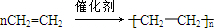 ,反应类型加聚反应.
,反应类型加聚反应. 分析 A是来自石油的重要有机化工原料,A得到的F是一种高聚物,可制成多种包装材料,A为乙烯,F为聚乙烯,B与D可以得到E,E是具有果香味的有机物,E为酯,故B为乙醇,D为乙酸,E为也实验装置,B催化氧化生成C,C为乙醛,据此解答.
解答 解:A是来自石油的重要有机化工原料,A得到的F是一种高聚物,可制成多种包装材料,A为乙烯,F为聚乙烯,B与D可以得到E,E是具有果香味的有机物,E为酯,故B为乙醇,D为乙酸,E为也实验装置,B催化氧化生成C,C为乙醛,
(1)由上述分析可知,A是乙烯,电子式为 ,
,
故答案为: ,;
,;
(2)D是乙酸,分子含有羧基,取少量物质与试管中滴加石蕊试液,若溶液变为红色,说明该物质含有-COOH
故答案为:羧基,取少量物质与试管中滴加石蕊试液,若溶液变为红色,说明该物质含有-COOH;
(3)反应④是乙烯发生加聚反应生成聚乙烯,反应方程式为: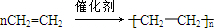 ,
,
故答案为: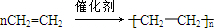 ,加聚反应.
,加聚反应.
点评 考查有机物的推断,涉及烯、醇、羧酸等性质与转化,难度不大,是对有机知识的总运用,有机推断是高考不变的一个题型,每年高考中必考,经常给出某反应信息要求学生加以应用,能较好的考查考生的阅读、自学能力和思维能力,是热点题型.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
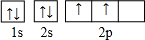 .
.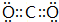 .
.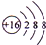 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是银白色的柔软金属,密度都比水小 | |
| B. | 单质在空气中燃烧生成的都是过氧化物 | |
| C. | 单质的熔沸点随着原子序数的增加而升高 | |
| D. | 碱金属单质与水剧烈反应生成碱和氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若HnXOm为强酸,则Y是活泼的非金属元素 | |
| C. | 若Y的最低化合价是-2,则Z的最高正价为+6 | |
| D. | 若X的最高正价为+5,则五种元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A}$(A-N+2m)mol | B. | $\frac{a}{A+m}$(A-N)mol | C. | $\frac{a}{A+m}$(A-N+2m)mol | D. | $\frac{a}{A+2m}$(A-N+m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com