
 ,丁香油酚不应具有的化学性质是( )
,丁香油酚不应具有的化学性质是( )| A. | 可以发生加聚反应 | B. | 可以与强碱溶液反应 | ||
| C. | 与NaHCO3反应放出CO2 | D. | 可与溴水发生加成反应 |
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
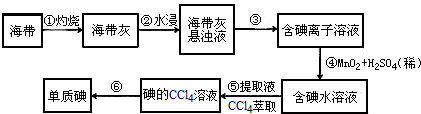
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
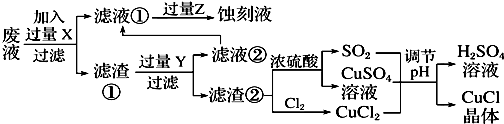
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Li<Na<K | B. | 沸点:HF<HCl<HBr<HI | ||
| C. | 稳定性:HCl>H2S>PH3 | D. | 还原性:F-<Cl-<Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体密度恒定不变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | H2、I2、HI的浓度相等 | |
| D. | H2、I2、HI在混合气体中体积分数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
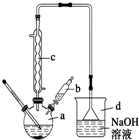 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
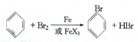 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com