
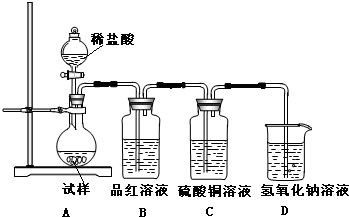
 化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
 SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O  H2SO3+OH-,HSO3-的电离程度大于水解程度,所以亚硫酸根离子的物质的量大于亚硫酸氢根;
H2SO3+OH-,HSO3-的电离程度大于水解程度,所以亚硫酸根离子的物质的量大于亚硫酸氢根; SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O  H2SO3+OH-,HSO3-的电离程度大于水解程度.
H2SO3+OH-,HSO3-的电离程度大于水解程度.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O |
| B、用硫酸酸化的桔红色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
| C、用氯酸钠的酸性溶液与H2O2作用制取ClO2:2ClO3-+H2O2+2H+=2ClO2↑+O2↑+2H2O |
| D、碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-=NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
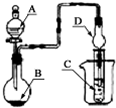
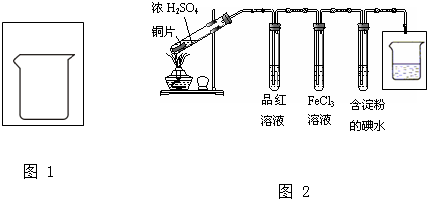
| A、若A为浓硫酸,B为铜,C中盛石蕊试液,则C中溶液先变红后褪色 |
| B、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C、若A为浓盐酸,B为二氧化锰,C中盛KI-淀粉溶液,则C中溶液变蓝 |
| D、若A为水,B为CaC2固体,C中盛溴水,则C中溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2、KSCN、NaCl、K2SO4(FeCl3溶液) |
| B、NaNO3、NaHCO3、Na2SO3、Na2SiO3(H2SO4溶液) |
| C、NaBr、Na2CO3、KI、CaCl2(AgNO3溶液) |
| D、NH4Cl、Mg(NO3)2、CuSO4、AlCl3(KOH溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:
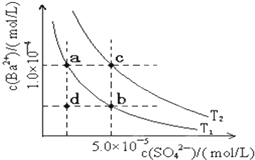 下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO32- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4?Ba2++SO42- | 1.07×10-10 | |
| BaCO3 | BaCO3?Ba2++CO32- | 2.58×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
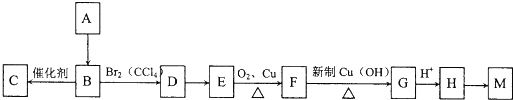
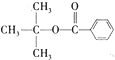 ),注:部分物质省略.
),注:部分物质省略.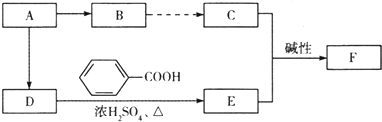

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C3H8、C4H6O2 |
| B、C2H6、C2H6O |
| C、C2H2、C6H6 |
| D、C3H6O、C3H8O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com