


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| NaCN |
| 醇溶液 |
| H2O |
| H2SO4 |
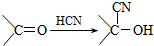
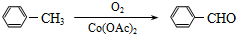
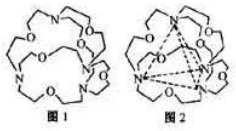
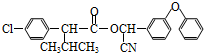 ):
):
 )的一取代物,含有碳碳叁键,X所有可能的结构共有
)的一取代物,含有碳碳叁键,X所有可能的结构共有查看答案和解析>>
科目:高中化学 来源: 题型:
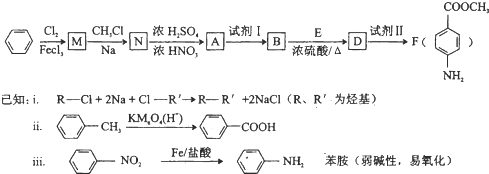
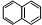
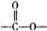 结构.
结构.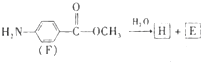
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PCl3与PCl5 |
| B、PCl3 |
| C、PCl5 |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
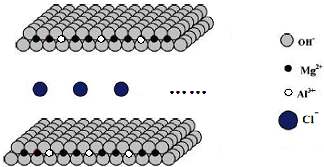 镁及其化合物在工业上有广泛的应用.
镁及其化合物在工业上有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA |
| B、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol?L-1 |
| D、10LpH=1的硫酸溶液中含有的H+离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
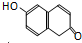 .下列关于该有机物的叙述正确的是( )
.下列关于该有机物的叙述正确的是( )| A、该有机物属于芳香烃 |
| B、该有机物苯环上一氯代物有6种 |
| C、该有机物可发生取代、加成、加聚、消去反应 |
| D、1 mol该有机物在适当条件下,最多可与3 mol Br2、5 mol H2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
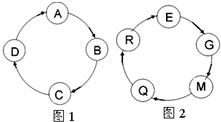 某九年级化学活动小组同学设计了一个小游戏--物质接龙即他们之间存在着顺时针转化的关系.
某九年级化学活动小组同学设计了一个小游戏--物质接龙即他们之间存在着顺时针转化的关系.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com