
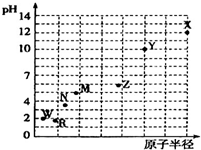
 第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )
第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )| A. | 气态氢化物的稳定性:R>W | |
| B. | Z的最高价氧化物对应的水化物能溶于稀氨水 | |
| C. | Y的单质是制造汽车、飞机、火箭的重要材料 | |
| D. | 简单离子的半径X的最大 |
分析 元素的金属性越强,其对应最高价氧化物的水化物碱性越强,则该溶液的pH越大,元素的非金属性越强,其最高价氧化物的水化物酸性越强则该溶液的pH越小,根据图象知,从R到X,最高价氧化物的水化物碱性逐渐增强、酸性逐渐减弱,其中硫酸为二元强酸,高氯酸为一元强酸,则硫酸的pH小于高氯酸,所以X、Y、Z、M、N、R、W分别为Na、Mg、Al、Si、P、S、Cl元素.
解答 解:元素的金属性越强,其对应最高价氧化物的水化物碱性越强则该溶液的pH越大,元素的非金属性越强,其最高价氧化物的水化物酸性越强则该溶液的pH越小,根据图象知,从R到X,最高价氧化物的水化物碱性逐渐增强、酸性逐渐减弱,X、Y、Z、M、N、W、R分别为Na、Mg、Al、Si、P、S、Cl元素.
A.元素的非金属性越强,其氢化物越稳定,Cl的非金属性大于S,则气态氢化物的稳定性:W>R,故A错误;
B.Z的最高价氧化物对应的水化物是氢氧化铝,氢氧化铝能溶于强碱但不能溶于弱碱,所以不能溶于稀氨水,故B错误;
C.Y是Mg,金属镁是制造汽车、飞机、火箭的重要材料,故C正确;
D.电子层数相同时原子序数越大离子半径越小,则X的离子半径最小,故D错误;
故选C.
点评 本题考查了同一周期元素性质递变规律,明确元素最高价氧化物的水化物酸碱性是解本题关键,再结合化合物的构成、性质来分析解答,题目难度中等.


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙醛能与氢气加成,而乙酸不能与氢气加成 | |
| C. | 乙醇能与金属钠反应,而甲醚不能与金属钠反应 | |
| D. | 苯酚能与NaOH溶液反应,而乙醇不能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究学习小组用如图装置进行铜与浓硫酸反应的实验研究.
某研究学习小组用如图装置进行铜与浓硫酸反应的实验研究.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下加热硝酸铵固体:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HNO3↑ | |
| B. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 工业制粗硅:C+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以FeCl3溶液区分KSCN、苯酚、NaOH、乙醇、AgNO3的水溶液 | |
| B. | 在含有少量苯酚的苯中加入足量浓溴水,过滤,以除去苯酚 | |
| C. | 溴乙烷中的乙烯可经过水洗分液后除去 | |
| D. | 乙酸乙酯中的乙酸可先加NaOH溶液、然后分液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的球棍模型: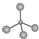 | B. | (CH3)3COH的名称:2,2二甲基乙醇 | ||
| C. | 乙醛的结构式:CH3CHO | D. | 羟基的电子式: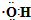 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为减缓反应速率,用饱和食盐水与电石反应制乙炔 | |
| B. | 进行酸碱中和滴定时,锥形瓶应用待测液润洗 | |
| C. | 实验室制乙烯时应将无水乙醇缓慢加入浓硫酸中,并加入碎瓷片以防爆沸 | |
| D. | 配制FeCl3溶液时,加入少量稀硫酸抑制其水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com