
向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是
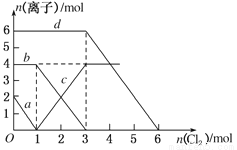
A.d曲线代表溶液中Br-变化情况
B.原溶液中FeI2的物质的量为2 mol
C.原溶液中n(Fe2+):n(Br-)=2:3
D.当通入2 mol Cl2时,溶液中离子反应为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年吉林省白城市高一上第一次月考化学试卷(解析版) 题型:填空题
(12分)(1)在标准状况下,有物质①4gH2,②33.6LCH4, ③1molH2O,④3.01×1023个O2,含分子数最多的是(填序号,下同) ,含原子数最少的是_____,质量最大的是_____,体积最小的_____;密度由大到小的顺序为:______________。
(2)含有相同氧原子数的CO和CO2 ,其质量比为 ;物质的量比为 ;
碳原子数比为 ;原子数比为 。
(3)含有电子数相等的CO和CO2 气体在同温同压下的体积比为 ;密度比为 。
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(8分)如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应。(不考虑NO2与N2O4的转化)
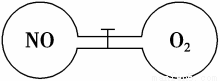
(1)开始时左右两室分子数 (填“相同”或“不相同”)。
(2)反应前后NO室压强 (填“增大”或“减小”) 。
(3)最终容器内密度与原来 (填“相同”或“不相同”)。
(4)最终容器内 (填“有”或“无”)O2存在。
查看答案和解析>>
科目:高中化学 来源:2016届全国推荐高三联考(二)化学试卷(解析版) 题型:填空题
(9分)将5.3 g某碱式碳酸盐固体(不含结晶水)M溶解于100 g 9.8%的稀硫酸中,充分反应后得到224 mL CO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液。向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如图所示。
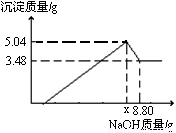
(1)由图可知,固体M与稀硫酸反应后所得溶液中除含有溶质MgSO4和Al2 (SO4)3外,还含有的溶质是______(写化学式)。
(2)加入的溶质NaOH从0.8 g到xg所发生反应的离子方程式为 。
(3)当加入溶质NaOH的质量到xg时,生成Al(OH)3的质量为 g,x= 。
(4)M的化学式为____。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三第一次测试理综化学试卷(解析版) 题型:选择题
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省张掖市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是
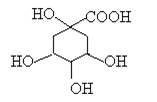
A.奎尼酸的分子式是C7H9O6
B.1mol奎尼酸与足量NaOH溶液反应,最多消耗NaOH物质的量为5mol
C.1 mol奎尼酸与足量钠反应生成56L氢气
D.奎尼酸能发生消去反应,也能与乙醇、乙酸发生取代反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷(解析版) 题型:实验题
(13分)铁的发现和大规模使用,是人类发展史上的一个光辉里程碑,它把人类从石器时代、青铜器时代带到了铁器时代,推动了人类文明的发展。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3 + 3NaClO + 4NaOH == 2Na2FeO4 + 3X + 5H2O, 则X的化学式 ,反应中被氧化的物质是 (写化学式)。
(2)铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为 ____ ;“滤渣A”主要成份的化学式为 。
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
FeS2 + Fe3 + + H2O == Fe2 + + SO42- + ___ 。
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 _______。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
如果pH过大,可能引起的后果是 __ (几种离子沉淀的pH见上表);滤液B可以回收的物质有(写化学式) 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一9月检测化学试卷(解析版) 题型:简答题
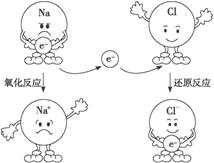
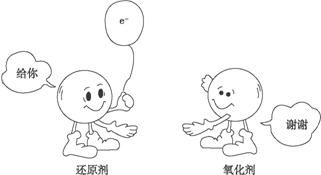
下图是以氯化钠为例表示的氧化反应、还原反应,以及氧化还原反应实质的示意图。认真分析示意图,总结归纳:什么是氧化反应?什么是还原反应 氧化还原反应的实质是什么?
______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com