C
分析:A、酸性条件下,N0
3-具有强氧化性,遇还原性离子会发生氧化还原反应;
B、反应的热效应由反应物总能量和生成物总能量的相对大小来决定.若反应物总能量大于生成物总能量,则为放热反应,反之为吸热反应;物质的稳定性与物质的键能有关,物质具有能量越高,则物质所含键能越小,该物质越不稳定.反之,物质具有能量越低,则键能越大,物质越稳定;
C、反应达到平衡时,正逆反应速率相等,从化学键的角度看就是断键速率和形成该键的速率相等;
D、亚硫酸的酸性大于碳酸的酸性,根据强酸制弱酸的原理写出离子方程式.
解答:A、酸性条件下,Fe
2+和 N0
3-发生氧化还原反应而不能大量共存,故A错误;
B、此反应的为放热反应,所以石墨比金刚石稳定,故金刚石中的共价键不如石墨中的共价键稳定,故B错误;
C、合成氨反应式为:N
2+3H
2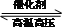
2NH
3,当有1N
AN≡N键形成的同时,就有6N
AN-H键形成,正逆反应速率相等,反应达到平衡状态,故C正确;
D、由于亚硫酸酸性比碳酸强,故反应应有二氧化碳气体放出,正确离子方程式为:CO
32-+2SO
2+H
2O=CO
2+2HSO
3-,故D错误;
故选:C.
点评:本题综合考察了离子共存、反应热、平衡状态的判断及离子方程式的书写等考点.本题易错选B,认为金刚石比石墨硬,则共价键稳定,不能从反应热的角度正确作出判断.

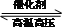 2NH3,当有1NAN≡N键形成的同时,就有6NAN-H键形成,正逆反应速率相等,反应达到平衡状态,故C正确;
2NH3,当有1NAN≡N键形成的同时,就有6NAN-H键形成,正逆反应速率相等,反应达到平衡状态,故C正确;
