
与[H+]·[OH-]=KW类似,FeS饱和溶液中存在:FeS(s)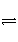
 Fe2+(aq)+S2-(aq),[Fe2+]·[S2-]=Ksp。常温下Ksp=8.1×10-17 mol2·L-2。
Fe2+(aq)+S2-(aq),[Fe2+]·[S2-]=Ksp。常温下Ksp=8.1×10-17 mol2·L-2。
(1)理论上FeS的溶解度为________________,而事实上其溶解度远大于这个数值,其原因可能是________________________________________________________________________
________________________________________________________________________。
(2)又知FeS饱和溶液中[H+]与[S2-]之间存在以下限量关系:[H+]2·[S2-]=1.0×10-22 mol3·L-3,为了使溶液中[Fe2+]达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的[H+]为________________________________________________________________。
(1)7.92×10-8g FeS在水中存在下列平衡:FeS(s)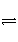
 Fe2+(aq)+S2-(aq),而Fe2+、S2-均可以发生水解:
Fe2+(aq)+S2-(aq),而Fe2+、S2-均可以发生水解:
Fe2++2H2O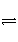
 Fe(OH)2+2H+、S2-+H2O
Fe(OH)2+2H+、S2-+H2O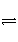
 HS-+OH-,使上述平衡中的[Fe2+]、[S2-]降低,平衡向右移动,造成更多的FeS溶解 (2)1.11×10-3 mol·L-1
HS-+OH-,使上述平衡中的[Fe2+]、[S2-]降低,平衡向右移动,造成更多的FeS溶解 (2)1.11×10-3 mol·L-1
解析 (1)由FeS(s)Fe2+(aq)+S2-(aq)
[Fe2+]=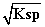 =
=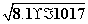 mol·L-1=9×10-9 mol·L-1
mol·L-1=9×10-9 mol·L-1
即1 L水中可溶解9×10-9 mol的FeS
由100∶S=1 000∶(9×10-9×88) g
所以S=7.92×10-8 g
(2)[Fe2+]=1 mol·L-1,则[S2-]=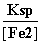 =
=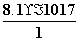 mol·L-1=8.1×10-17 mol·L-1。又[H+]2·[S2-]=1.0×10-22 mol3·L-3,所以[H+]=
mol·L-1=8.1×10-17 mol·L-1。又[H+]2·[S2-]=1.0×10-22 mol3·L-3,所以[H+]=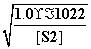 mol·L-1=
mol·L-1=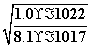 mol·L-1=1.11×10-3 mol·L-1。
mol·L-1=1.11×10-3 mol·L-1。


科目:高中化学 来源: 题型:
某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混 合反应.
合反应.
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________________。
此方案第一步的实验装置如下图所示:
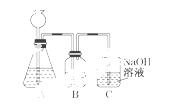
(2)加入反应物前,如何检验整个装置的气密性________________________________________。
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是______,作用___________________。
(4)在实验室通常制法中,装置A还可作为下列______(填序号)气体的发生装置。
①CH4 ②H2 ③Cl2 ④CH2===CH2
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
现向含AgBr的饱和溶液中:
(1)加入固体AgNO3,则[Ag+]________(填“变大”、“变小”或“不变”,下同);
(2)加入更多的AgBr固体,则[Ag+]________;
(3)加入AgCl固体,则[Br-]________,[Ag+]________;
(4)加入Na2S固体,则[Br-]________,[Ag+]________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关AgCl沉淀的溶解平衡说法正确的是( )
A.AgCl沉淀生成和沉淀溶解达平衡后不再进行
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子的物质的量为
( )
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在50 mL 0.2 mol·L-1 CuSO4溶液中插入两个电极,通电电解(不考虑水分蒸发)。则:
(1)若两极均为铜片,试说明电解过程中CuSO4溶液的浓度________(填“增大”、“减小”或“不变”)。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是________________________________________________________________________
________________________________________________________________________。
(3)若阳极为纯锌,阴极为铜片,如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重________g,阴极上的电极反应式是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量浓度、等体积的氢氧化钠溶液和醋酸溶液完全反应后,溶液中有关离子浓度之间不存在的关系是( )
A.[H+][OH-]=KW
B.[Na+]>[CH3COO-]>[OH-]>[H+]
C.[Na+]=[CH3COO-]+[OH-]
D.[Na+]+[H+]=[CH3COO-]+[OH-]
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=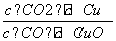
B.反应③的平衡常数K=K1/K2
C.对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容时,若增大压强,H2的浓度一定减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com