
| A. | N2和O2 | B. | Na和O2 | C. | S和O2 | D. | Al和O2 |
分析 A.氮气与氧气反应生成一氧化氮,产物与反应条件、反应物的用量无关;
B.Na和O2反应的条件的不同,生成物也不同;
C.硫与氧气反应生成二氧化流,产物与反应条件、反应物的用量无关;
D.铝与氧气反应生成氧化铝,产物与反应条件、反应物的用量无关.
解答 解:A.N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,产物与反应条件、反应物的用量无关,故A不选;
B.Na和O2在常温下反应生成氧化钠,Na和O2在加热条件下反应生成氧化钠,反应条件改变,会引起产物的种类改变,故B选;
C.S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,产物与反应条件、反应物的用量无关,故C不选;
D.4Al+3O2=2Al2O3,无论在常温下还是在加热条件下都生成氧化铝,产物与反应条件、反应物的用量无关,故D不选;
故选B.
点评 本题是对物质之间反应物量的不同导致的结果不同的考查,解题的关键是掌握具体的反应产物的不同,属于物质之间反应的探讨,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为35、中子数为45的溴原子:3545Br | |
| B. | Al3+的结构示意图: | |
| C. | 羟基的电子式: | |
| D. | 乙醇的结构简式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g铁粉与酸反应失去的电子数是NA | |
| B. | 标准状况下,11.2 L NH3含有的原子总数为1.5NA | |
| C. | 0.5 mol•L-1 K2SO4溶液中所含K+的数目为NA | |
| D. | 46 g N02和N2O4的混合气体含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgF2的电子式: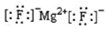 | |
| B. | 中子数为15的硅原子:${\;}_{14}^{29}$Si | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | NH3•H2O 的电离方程式:NH3•H2O?NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO 3-═3Fe 3++2H2O+NO↑ | |
| B. | 氧化亚铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | 固体氯化钠与浓硫酸混合加热:H 2SO 4+2Cl-═SO 2↑+Cl 2↑+H 2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 普通玻璃、水泥成分中都含有这三种元素 | |
| B. | 自然界中存在单质硅 | |
| C. | 氧元素与另外两种元素形成的二元化合物都能与NaOH的浓溶液反应 | |
| D. | 电解熔融状态的SiO2和A12O3可以制得Si、A1,且都有氧气生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com