
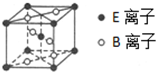
 A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:分析 A、B、C、D、E五种常见元素,它们的核电荷数依次增大.E的基态原子3d轨道上有2个电子,原子核外电子排布式为1s22s22p63s23p63d24s2,则E为Ti;B是地壳中含量最多的元素,则B为O元素;C是短周期中最活泼的金属元素,则C为Na;D与C可形成CD型离子化合物,则D为Cl;A的基态原子中有2个未成对电子,原子序数小于氧,原子核外电子排布式为1s22s22p2,故A为碳元素,据此解答.
解答 解:A、B、C、D、E五种常见元素,它们的核电荷数依次增大.E的基态原子3d轨道上有2个电子,原子核外电子排布式为1s22s22p63s23p63d24s2,则E为Ti;B是地壳中含量最多的元素,则B为O元素;C是短周期中最活泼的金属元素,则C为Na;D与C可形成CD型离子化合物,则D为Cl;A的基态原子中有2个未成对电子,原子序数小于氧,原子核外电子排布式为1s22s22p2,故A为碳元素.
(1)E的基态3d轨道上有2个电子,原子核外电子排布式为1s22s22p63s23p63d24s2,基态原子价层电子排布式为3d24s2,
故答案为:3d24s2;
(2)ClO2-中Cl原子孤电子对数=$\frac{7+1-2×2}{2}$=2,价层电子对数=2+2=4,为V形结构,同周期自左而右电负性增大,非金属性越强电负性越大,故电负性O>C>Na,
故答案为:V形;O>C>Na;
(3)CO2形成的晶体属于分子晶体,NaCl属于离子晶体,离子键强于分子间作用力,通常情况下,离子晶体熔点大于分子晶体熔点,故CO2形成的晶体的熔点低于NaCl,
故答案为:低于;CO2形成的晶体属于分子晶体,NaCl属于离子晶体,离子键强于分子间作用力;
(4)该晶胞中Ti原子个数=1+8×$\frac{1}{8}$=2、O原子个数=2+4×$\frac{1}{2}$=4,则Ti、O原子个数之比=2:4=1:2,则化学式为TiO2,TiO2放在电炉中,通入Cl2和碳的单质后高温加热,可制得TiCl4,同时产生一种造成温室效应的气体,该气体为二氧化碳,该反应的化学方程式为:TiO2+C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+CO2,
故答案为:TiO2+C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+CO2.
点评 本题是对物质结构的考查,涉及晶胞计算、杂化轨道、电负性、核外电子排布、晶体性质等,推断元素是解题关键,注意利用均摊法进行晶胞计算.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
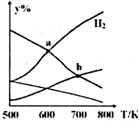 以CO2和H2为原料制取乙醇的反应为:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H<0.某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示.下列说法正确的是( )
以CO2和H2为原料制取乙醇的反应为:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H<0.某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示.下列说法正确的是( )| A. | a点的平衡常数小于b点 | B. | b点:v正(CO2)=v逆(H2O) | ||
| C. | a点:n(H2)=n(H2O) | D. | 温度不变,充入更多H2,D(CO2)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
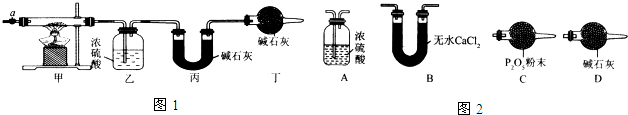
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
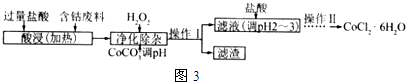
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究Na与水反应可能有O2生成 | |
| B. | 探究Na2O2与SO2反应可能有Na2SO4生成 | |
| C. | 探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能含有CuS | |
| D. | 探究向滴有酚酞的NaOH溶液中通入Cl2,溶液红色褪去的原因是溶液酸碱性改变所致,还是HClO的漂白性所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO | B. | N2O3 | C. | NO2 | D. | N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
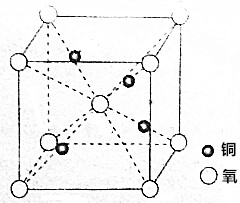 铜的一种氧化物在陶瓷涂色等方面有重要应用,它的晶胞如图所示.
铜的一种氧化物在陶瓷涂色等方面有重要应用,它的晶胞如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
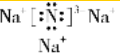 .
. ,写出另一种盐的电子式
,写出另一种盐的电子式 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com