
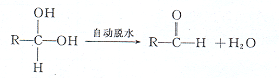
 .
. 、
、 .
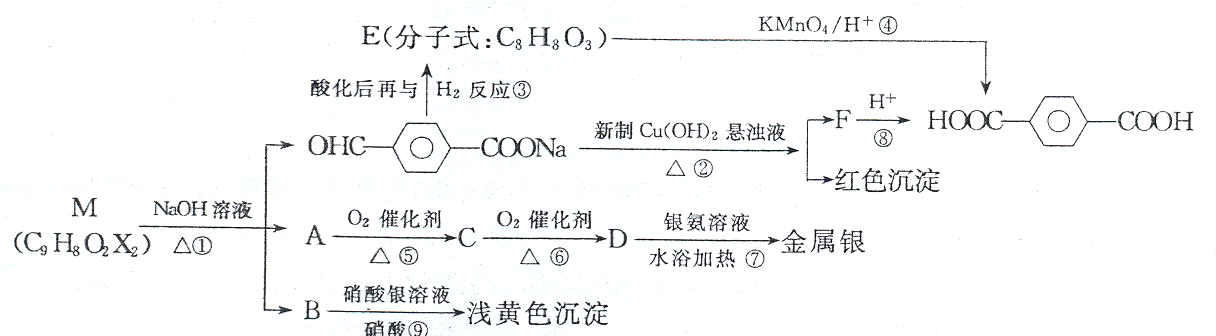
. 分析 M和氢氧化钠的水溶液发生水解反应生成A、B和 ,B和硝酸酸化的硝酸银溶液反应生成淡黄色沉淀AgBr,则B为NaBr,同时说明M中X元素为Br元素,A能连续被氧化,说明A为醇,生成的D为酸,酸能和银氨溶液发生银镜反应,说明D为HCOOH,则A为CH3OH、C为HCHO;
,B和硝酸酸化的硝酸银溶液反应生成淡黄色沉淀AgBr,则B为NaBr,同时说明M中X元素为Br元素,A能连续被氧化,说明A为醇,生成的D为酸,酸能和银氨溶液发生银镜反应,说明D为HCOOH,则A为CH3OH、C为HCHO;
M中只含两个O原子,且M属于酯,说明M中含有酯基,根据 知,M为苯甲酸酯,而
知,M为苯甲酸酯,而 中的醛基是由两个醇羟基失水形成的,则M中两个-Br位于同一个C原子上,其结构简式为
中的醛基是由两个醇羟基失水形成的,则M中两个-Br位于同一个C原子上,其结构简式为 ,
, 和新制氢氧化铜悬浊液反应生成F,F结构简式为
和新制氢氧化铜悬浊液反应生成F,F结构简式为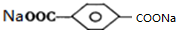 ,
, 酸化后再和氢气发生加成反应生成E,根据E分子式知,E的结构简式为
酸化后再和氢气发生加成反应生成E,根据E分子式知,E的结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:M和氢氧化钠的水溶液发生水解反应生成A、B和 ,B和硝酸酸化的硝酸银溶液反应生成淡黄色沉淀AgBr,则B为NaBr,同时说明M中X元素为Br元素,A能连续被氧化,说明A为醇,生成的D为酸,酸能和银氨溶液发生银镜反应,说明D为HCOOH,则A为CH3OH、C为HCHO;
,B和硝酸酸化的硝酸银溶液反应生成淡黄色沉淀AgBr,则B为NaBr,同时说明M中X元素为Br元素,A能连续被氧化,说明A为醇,生成的D为酸,酸能和银氨溶液发生银镜反应,说明D为HCOOH,则A为CH3OH、C为HCHO;
M中只含两个O原子,且M属于酯,说明M中含有酯基,根据 知,M为苯甲酸酯,而
知,M为苯甲酸酯,而 中的醛基是由两个醇羟基失水形成的,则M中两个-Br位于同一个C原子上,其结构简式为
中的醛基是由两个醇羟基失水形成的,则M中两个-Br位于同一个C原子上,其结构简式为 ,
, 和新制氢氧化铜悬浊液反应生成F,F结构简式为
和新制氢氧化铜悬浊液反应生成F,F结构简式为 ,
, 酸化后再和氢气发生加成反应生成E,根据E分子式知,E的结构简式为
酸化后再和氢气发生加成反应生成E,根据E分子式知,E的结构简式为 ,
,
(1)通过以上分析知,X为Br元素,反应①的反应类型是水解反应,
故答案为:Br;水解反应;
(2)通过以上分析知,M的结构简式为: ,故答案为:
,故答案为: ;
;
(3)E为 ,E互为同分异构体同时符合下列四个条件
,E互为同分异构体同时符合下列四个条件
①含酯基,②含酚羟基,③不能发生银镜反应说明不是甲酸酯,④苯环上的一氯取代物只有2种,说明两个取代基位于对位,符合条件的同分异构体有 、
、 ,
,
故答案为: 、
、 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,正确推断A的结构是解本题关键,注意结合题给信息解答,以D为突破口进行推断,难点是(3)题同分异构体种类判断.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L AgNO3溶液:H+、K+、SO42-、I- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- | |
| D. | $\frac{{K}_{W}}{C({H}^{+})}$=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手持试管给试管内的物质加热 | |
| B. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| C. | 用天平称量药品时用手直接拿砝码 | |
| D. | 用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,不能与任何酸溶液反应 | |
| B. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| C. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏大 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) | 0.73 | 1.02 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.18 |
| 最高或最 低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠溶液可使酚酞试液变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | NaHS水解:HS-+H2O═S2-+H3O+ | |
| C. | 向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | 向AgCl的悬浊液中滴入少量Na2S溶液:2AgCl+S2-═Ag2S+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铅蓄电池放电时负极质量减少 | |
| B. | 在海轮外壳连接镁合金保护外壳不受腐蚀 | |
| C. | 对于同一个化学反应,一步完成和分步完成其反应的焓变亦不相同 | |
| D. | 反应 MnO4-+H2O2+H+═Mn2++H2O+O2(未配平)中每生成1 mol O2转移2 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm. |
| Y | 所在主族序数与所在周期序数之差为4. |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰. |
| D | 最高价氧化物对应的水化物,能电离出离子数、电子数都相等的阴、阳离子. |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com