
| A. | 反应①是置换反应 | B. | ①②均属于氧化还原反应 | ||
| C. | 每消耗1mol TiO2会生成56g CO | D. | 反应②中镁元素化合价升高 |
分析 A、①反应物有三种物质,所以不是置换反应;
B、①②均有元素化合价的变化;
C、由反应方程式:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,每消耗1mol TiO2会生成2mol的CO;
D、反应②中镁由0价变成+2价.
解答 解:A、①反应物有三种物质,所以不是置换反应,故A错误;
B、①②均有元素化合价的变化,所以都是氧化还原反应,故B正确;
C、由反应方程式:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,每消耗1mol TiO2会生成2mol的CO,质量为:56g,故C正确;
D、反应②中镁由0价变成+2价,所以镁元素化合价升高,故D正确;
故选A.
点评 本题考查氧化还原反应与四种基本反应类型的关系,明确有元素化合价变化的反应属于氧化还原反应即可解答.


科目:高中化学 来源: 题型:解答题
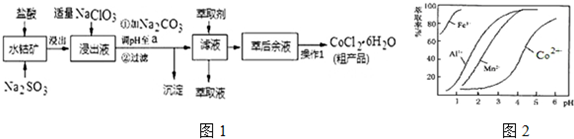
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O+H2O═2NaOH | B. | Zn+H2SO4(稀)═ZnSO4+H2↑ | ||
| C. | 2AgNO3═2Ag+2NO2↑+O2↑ | D. | 3NO2+H2O═2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用激光笔照射煮沸过的FeCl3溶液可观察到明亮光路 | |
| B. | 大雾天气用汽车远光灯照射前方常出现明亮光路 | |
| C. | 明矾可用作净水剂 | |
| D. | 臭氧、Cl2均可用于水的消毒净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为16的氧原子:${\;}_{16}^{8}$O | |
| B. | 苛性钠化学式:Na2CO3 | |
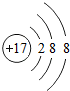
| C. | 镁离子结构示意图: | |
| D. | 次氯酸钠在水中电离:NaClO═Na++Cl-+O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的淀粉碘化钾试纸检验是否有Cl- | |
| B. | 用托盘天平称取12.6g Na2SO4固体粉末 | |
| C. | 通过分液方法分离酒精和水 | |
| D. | 将250g Cu2SO4•5H2O固体溶于1L水,配制1 mol•L-1 CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡向右移动 | C. | B的转化率升高 | D. | C的体积分数降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA电离出的c(H+)与水电离出的c(H+)之比为108 | |
| B. | 升高温度,溶液的pH减小 | |
| C. | 溶液的pH=4 | |
| D. | HA的电离平衡常数约为l×10-7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com