
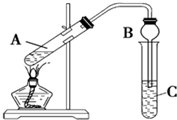
 某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL冰醋酸混合,分别进行制取乙酸乙酯的研究.
某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL冰醋酸混合,分别进行制取乙酸乙酯的研究.| 组序号 | 催化剂 | 反应现象 | C中饱和碳酸钠溶液中酯层高度 |
| ① | 2mL 98%浓硫酸 | 20秒时溶液出现棕色,随反应进行,溶液颜色逐步加深,最后成黑色;酯层无气泡 | 2.10cm |
| ② | 2mL14mol?L-1 硫酸 | 反应后溶液呈浅棕色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.14cm |
| ③ | 2mL10mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.16cm |
| ④ | 2mL7mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠界面有气泡 | 2.00cm |
| ||
| △ |
| ||
| △ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、该溶液中氯化镁的物质的量浓度为1mol/L |
| B、CI--的物质的量浓度为2mol/L |
| C、含溶质氯化镁的质量为47.5g |
| D、取出0.25 L倒入烧杯中CI--的浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低温度,使平衡正向移动 |
| B、体积不变充入N2使压强增大 |
| C、体积不变充入He使气体压强增大 |
| D、保持总压强不变,充入Ne气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 |
| 乙醇 | -144 | 78.0 | 0.789 |
| 乙酸 | 16.6 | 118 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0,900 |
| 浓硫酸(98%) | - | 338 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁合金中常含有碳,铁、碳材料在日常生活、工业生产和科学研究中具有极其重要的用途.回答以下问题:
铁合金中常含有碳,铁、碳材料在日常生活、工业生产和科学研究中具有极其重要的用途.回答以下问题:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、Cu2+ |
| B、Cu2+、Zn2+ |
| C、Zn2+、Fe2+ |
| D、Zn2+、Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com