
| A. | 二项 | B. | 三项 | C. | 五项 | D. | 全部 |
分析 ①用蒸发皿加热食盐水提取氯化钠;
②存在溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),加入足量饱和FeCl3溶液,将氢氧化镁沉淀转化成氢氧化铁沉淀;
③加热碳酸钠不能得到小苏打,但加热小苏打可以得到碳酸钠;
④三溴苯酚溶于苯,且苯与溴互溶;
⑤地壳中含量最高的金属元素是铝;
⑥观察火焰颜色应该通过蓝色的钴玻璃观察.
解答 解:①坩埚用于固体灼烧,用蒸发皿加热食盐水提取氯化钠,故错误;
②存在溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),加入足量饱和FeCl3溶液,将氢氧化镁沉淀转化成氢氧化铁沉淀,充分搅拌后过滤可以除去杂质氢氧化镁,故正确;
③加热碳酸钠不能得到小苏打,但加热小苏打可以得到碳酸钠,故错误;
④三溴苯酚溶于苯,且苯与溴互溶,不能用浓溴水除去苯中的苯酚,可以先用氢氧化钠溶液与苯酚反应,再利用分液分离,故错误;
⑤地壳中含量最高的金属元素是铝,在金属元素中Fe元素含量是第二位,故错误;
⑥观察钾的火焰颜色应该通过蓝色的钴玻璃观察,滤去钠的黄光,不是紫色钴玻璃,故错误.
故选:C.
点评 本题考查实验基本操作、物质的分离提纯、一定物质的量浓度溶液配制、元素化合物性质等,注意根据平衡移动原理理解利用沉淀转化进行除杂.


科目:高中化学 来源: 题型:多选题
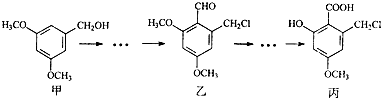
| A. | 甲、乙、丙三种有机化合物均可跟NaOH溶液反应 | |
| B. | 用FeCl3溶液区分甲、丙两种有机化合物 | |
| C. | 一定条件下丙可以与NaHCO3溶液、C2H5OH反应 | |
| D. | 乙、丙都能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44 g C3H8中含有的共价键数为11 NA | |
| B. | 0.1 mol醛基中的电子数为1.5NA | |
| C. | 室温下,28.0 g乙烯和一氧化碳的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4 L乙醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3COOH+BaCO3→(CH3COO)2Ba+CO2↑+H2O | |
| B. | CH3COOH+KHCO3→CH3COOK+CO2↑+H2O | |
| C. | 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O | |
| D. | CH3COOH+Na2CO3→CH3COONa+NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、NaNO3、NH4Cl | B. | K2CO3、HCl、CaCl2 | ||
| C. | Na2CO3、HNO3、HCl | D. | K2CO3、KCl、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
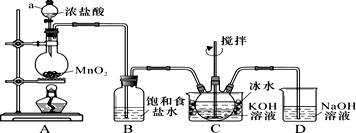
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 | |
| B. | 月桂烯(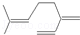 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 甲苯能使溴水和KMnO4溶液褪色 | |
| D. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com