
分析 (1)列出三段式计算,化学反应速率是单位时间内物质浓度的变化计算得到;
(2)变化量之比=化学方程式的系数之比计算得到;
(3)反应平衡时,D为 2amol,则a=2amol,计算得到B的转化率;
(4)依据(3)的平衡物质的量,如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,说明升温平衡逆向进行;
(5)体积变小压强增大速率增大,平衡逆向进行.
解答 解:(1)根据题干信息结合平衡三段式列式,A减少量和生成C的物质的量之比等于速率之比等于计量数之比,平均反应速率vC=vA/2,
xA(g)+yB(g)?pC(g)+qD(g)
起始量(mol) a b 0 0
变化量(mol) $\frac{1}{3}$a $\frac{a}{2}$ $\frac{a}{6}$ a
平衡量(mol) $\frac{2}{3}$a b-$\frac{a}{2}$ $\frac{a}{6}$ a
用A表示的反应速率vA=$\frac{\frac{\frac{1}{3}amol}{2L}}{2min}$=$\frac{a}{12}$mol•L-1•min-1
故答案为:$\frac{a}{12}$ mol•L-1•min-1;
(2)依据(1)的列式计算x:y:p:q=$\frac{a}{3}$:$\frac{a}{2}$:$\frac{a}{6}$:a=2:3:1:6
x=2,y=3,p=1,q=6;
故答案为:2,3,1,6;
(3)反应平衡时,D为 2amol,则a=2amol,则B的转化率为=$\frac{\frac{a}{2}}{b}$×100%=$\frac{a}{b}$×100%,
故答案为:$\frac{a}{b}$×100%;
(4)依据(3)的平衡物质的量,如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,说明升温平衡逆向进行,逆向是吸热反应,正向是放热反应,△H<0;
故答案为:<;
(5)如果其他条件不变,将容器的容积变为 1L;是体积缩小的变化;压强增大,反应速率增大,反应是:2A(g)+3B(g)?C(g)+6D(g)
①体积减小,压强增大,物质的浓度增大,反应速率增大;反应向气体体积减小的反应方向进行;
②将容器的容积变为 1L,压强增大,反应速率增大,平衡向气体体积减小的反应方向进行,即向逆向进行,反应物转化率减小;
故答案为:减小;体积减小,气体的压强增大,平衡向气体分子数少的方向(即逆反应方向)移动,因而使反应物转化率减小.
点评 本题考查了化学反应速率的计算判断,化学平衡影响因素的分析理解,三段式计算的应用,物质转化率的计算,掌握化学平衡的基础是解题关键,题目难度中等.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:实验题
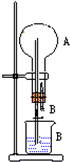 在图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶.
在图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶.| A | B | 喷泉颜色 | |
| 途经1 | |||
| 途经2 | |||
| 途经3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 品名:XX火腿肠 净含量:150g 生产日期:见封口 保质期:25℃以下6个月 配料:精选瘦肉、大豆蛋白、鸡蛋、淀粉、白砂糖、食盐、 食用香精、山梨酸钾、亚硝酸钠、维生素C 储存指南:避免日晒,置阴凉干燥处 生产厂家:XX食品有限公司 地址:XX市XX路XX号 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
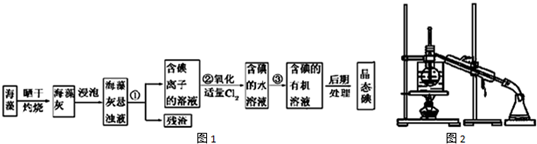
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HCO3-)>c(ClO-)>c(OH-) | B. | c(ClO-)>c(HCO3-)>c(H+) | ||
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | D. | c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
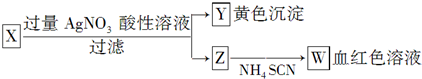
| A. | Z中一定有Fe3+ | B. | X中一定有Fe2+ | C. | Y为AgBr沉淀 | D. | X一定为FeBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有7个主族,7个副族 | |
| B. | VIA族元素原子的最外层电子数均为6 | |
| C. | 碳元素位于第二周期ⅣA族 | |
| D. | 氢分子中的化学键是极性共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com